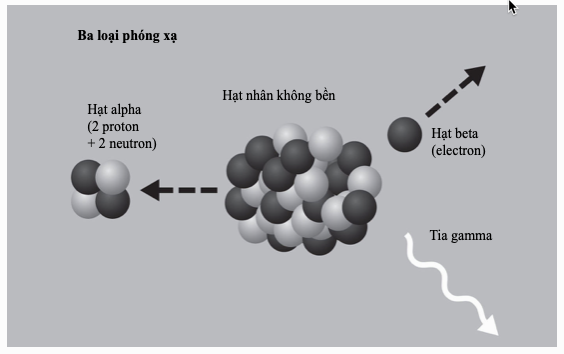
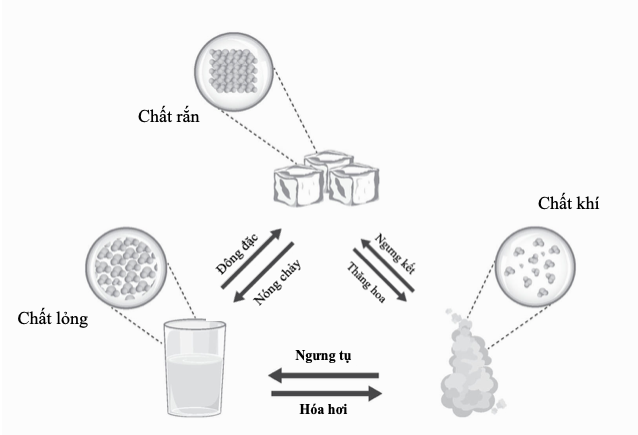
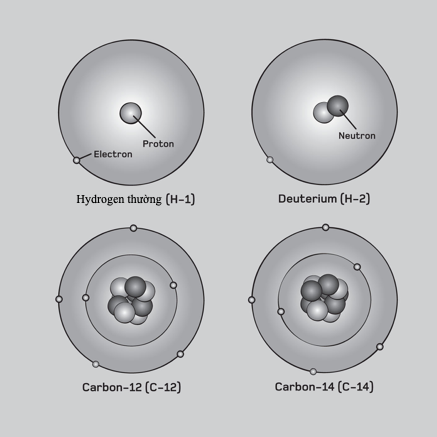
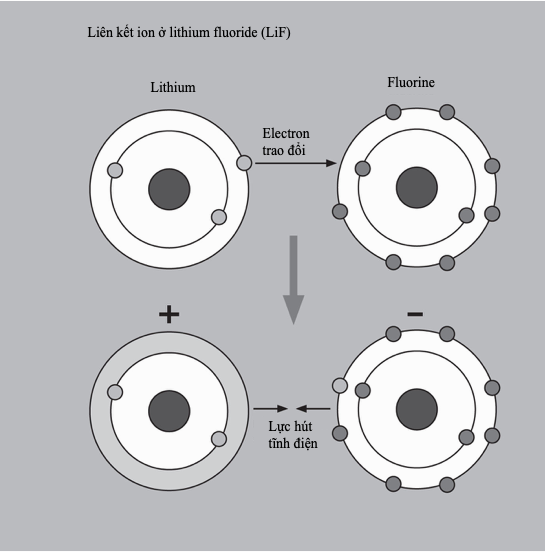
Mẫu Bohr
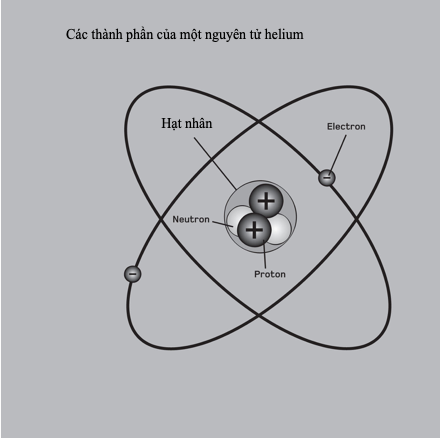
Mẫu “hành tinh” nguyên tử của Rutherford chưa từng được các nhà khoa học xem xét nghiêm túc. Nó không đủ cơ sở để giải thích mỗi nguyên tử được liên kết như thế nào, và các nguyên tử liên kết với nhau như thế nào để tạo thành các hợp chất hóa học. Chẳng hạn, người ta biết rằng các điện tích đang gia tốc phát ra ánh sáng, cho nên mỗi electron trong quỹ đạo tròn (có gia tốc không đổi hướng về tâm quỹ đạo) sẽ phát ra ánh sáng, mất năng lượng và không khỏi chuyển động xoáy ốc vào trong hạt nhân. Cấu trúc vi mô mới được khám phá của vật chất rõ ràng đòi hỏi một nền vật lí mới để mô tả nó.
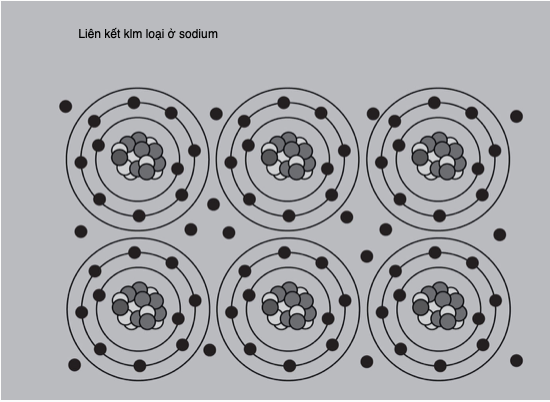
Nhằm giải thích quang phổ hấp thụ và phát xạ không liên tục của hydrogen, Niels Bohr (1885-1962) đề xuất vào năm 1913 rằng các electron chiếm giữ các mức năng lượng xác định, hay bị “lượng tử hóa”, hay các “lớp vỏ” xung quanh hạt nhân nguyên tử. Mỗi mức chứa được một số electron nhất định, sau đó chúng điền đầy lớp vỏ tiếp theo từ trong ra ngoài. Các vạch phổ cho biết năng lượng cần thiết để một electron “nhảy” vào một lớp vỏ phía ngoài, hay năng lượng phát ra khi nó rơi trở vào một mức năng lượng thấp hơn.

Niels Bohr
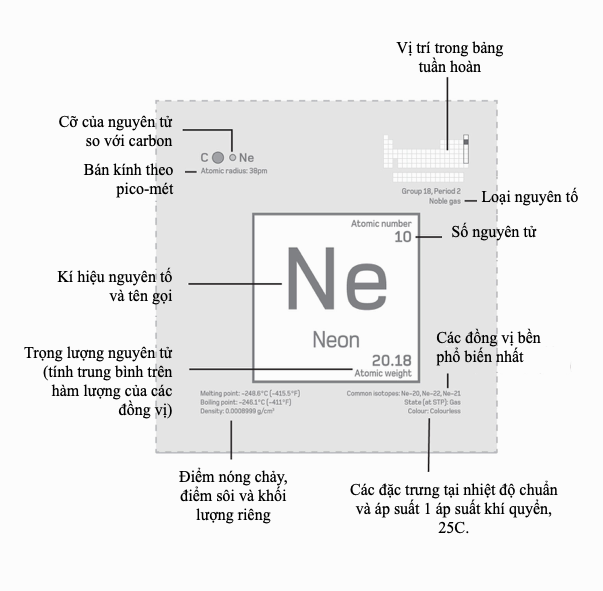
Số nguyên tử
Vào năm 1913, nhà vật lí trẻ người Anh Henry Moseley (1887–1915) giải được một nan đề đã hành hạ các nhà hóa học trong phần lớn thế kỉ 19 – đó là, có gì là cơ bản hay không đối với các kiểu hình nhìn thấy trong bảng tuần hoàn, hay nó chẳng gì hơn là một danh sách mua sắm các nguyên tố? Các bảng được xếp trật tự theo trọng lượng nguyên tử tăng dần có chứa những mâu thuẫn đáng kể, nhưng thay vậy Moseley lại nhìn vào phổ tia X đặc trưng mà các nguyên tố phát ra. Ông tìm thấy rằng căn bậc hai của bước sóng tia X biểu hiện một sự tiến triển rõ ràng, gợi ý rằng có cái gì đó cơ bản đang thay đổi từ nguyên tố nay sang nguyên tố khác. Số nguyên tử của mỗi nguyên tố – số thứ tự của nó trong bảng tuần hoàn – trước đây bị xem là tầm thường, song Moseley nhận thấy một thực tại nền tảng cho trật tự của các nguyên tố, được trụ đỡ bởi một tính chất cơ bản, có thể đo được. Ông suy đoán rằng số nguyên tử là bằng với số lượng proton trong hạt nhân, và các ô trống đã được nhận dạng trong bảng tuần hoàn là tương ứng với các số nguyên tử 43 (ngày nay gọi là technetium), 61 (promethium), 72 (hafnium), và 75 (tantalum).
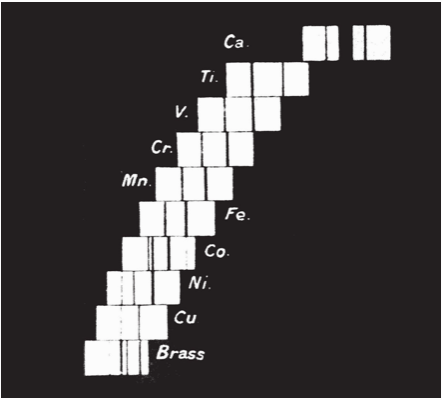
Phim chụp phổ phát xạ tia X từ hạt nhân của một số nguyên tố hóa học.
Bảng tuần hoàn hóa học tốc hành | Dan Green
Bản dịch của Thuvienvatly.com