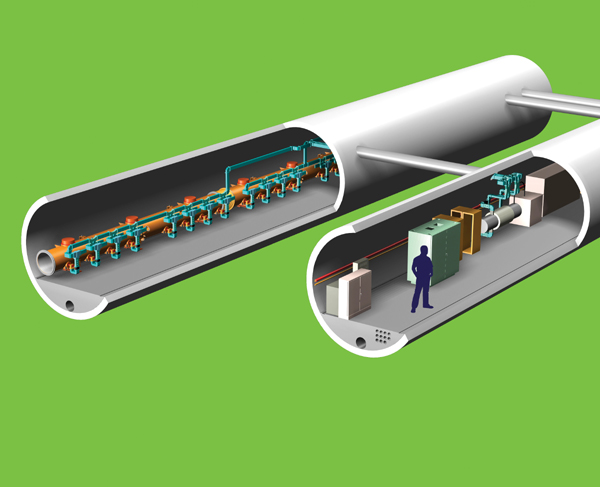
Cấu hình electron
Các electron trong quỹ đạo xung quanh một hạt nhân nguyên tử không thể chiếm bất kì vị trí nào mà chúng muốn. Thay vậy, chúng chiếm giữ các orbital nguyên tử, sắp xếp thành các “lớp vỏ” gắn liền với một năng lượng (bị lượng tử hóa) nhất định. Mỗi lớp vỏ chứa một số electron nhất định và khi nó đầy, các electron bắt đầu lấp đầy mức tiếp theo. Theo vật lí lượng tử, các orbital không phải những cấu trúc có hình dạng rạch ròi, mà thay vậy chúng là “những vùng xác suất” ranh mờ, trong đó có xác suất 95% tìm thấy một electron. Khoảng trống giữa các orbital là nơi không bao giờ tìm thấy electron nào.
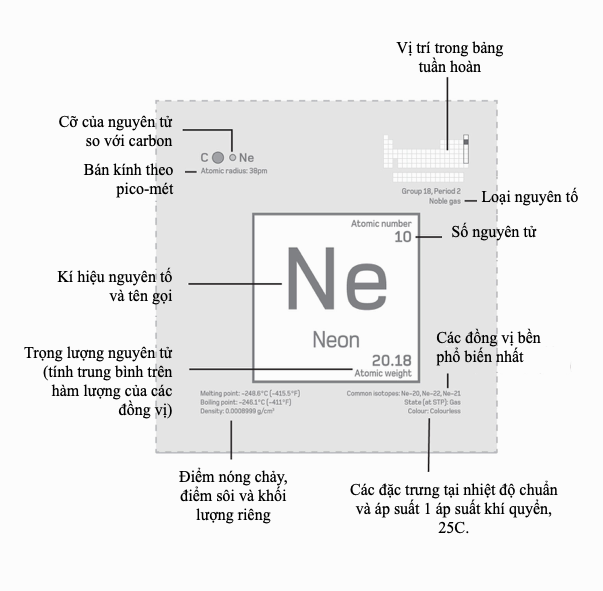
Cấu hình electron của một nguyên tố là chìa khóa cho tính chất vật lí và hành trạng hóa học của nó. Số lượng electron trong lớp vỏ ngoài cùng (còn gọi là lớp vỏ hóa trị) và năng lượng của chúng có vai trò lớn trong việc định đoạt kiểu liên kết và các loại hợp chất và dạng thù hình của nguyên tố. Các electron trong những orbital gần hạt nhân được liên kết mạnh nhất, và một lớp vỏ hóa trị được lấp đầy là một cấu hình electron bền hơn. Cấu hình này cũng giải thích nhiều “khuynh hướng quan sát thấy trong bảng tuần hoàn”.
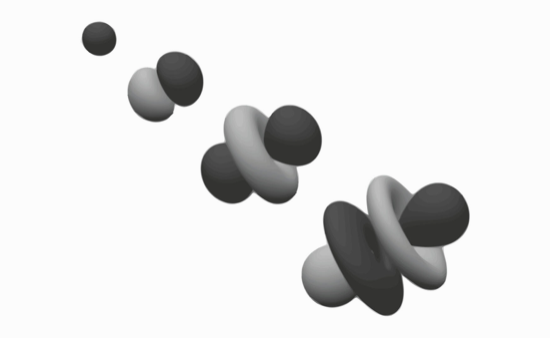
Các electron không quay xung quanh hạt nhân nguyên tử giống như các hành tinh quay xung quanh Mặt Trời. Thay vậy, chúng nhạt nhòe, tạo thành một “đám mây electron” vây xung quanh hạt nhân. Chúng bị giam cầm trong các không gian hạn chế, gọi là orbital, sắp xếp xung quanh hạt nhân. Hình dạng của các orbital này được xác định bởi các hàm toán học.
Các lực trong hạt nhân
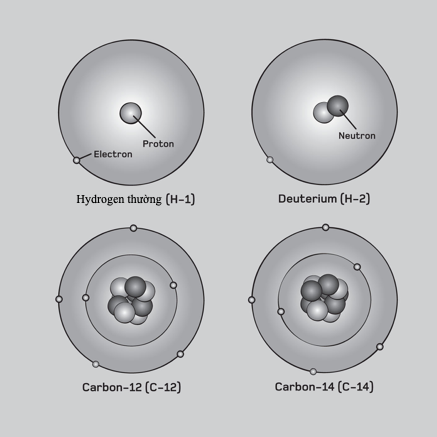
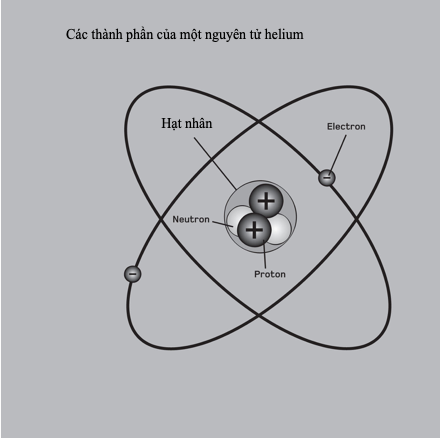
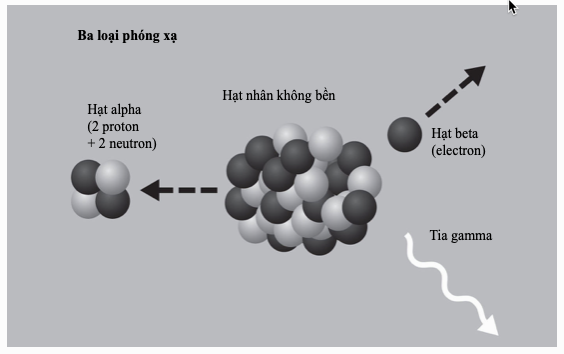
Hydrogen, nguyên tố đơn giản nhất, có đúng một proton tích điện dương cho hạt nhân của nó. Tuy nhiên, các nguyên tố nặng hơn có nhiều proton hơn, vậy làm thế nào hạt nhân thắng được lực đẩy tĩnh điện giữa các điện tích dương này? Câu trả lời nằm ở lực mạnh (hay “tương tác hạt nhân mạnh”), một lực hút tầm ngắn tác dụng trên các khoảng cách femto-mét (1 x 10–15 m). Nó không những hút các proton và neutron lại với nhau, mà còn liên kết các quark để tạo nên chính các nucleon. Một lực khác nữa tác dụng trong hạt nhân – lực yếu – cho phép các neutron thỉnh thoảng biến thành proton trong phân hủy phóng xạ beta.
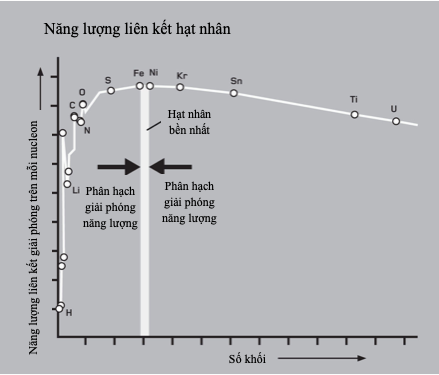
Khối lượng kết hợp của các nucleon trong một hạt nhân nhỏ hơn một chút so với tổng khối lượng tách riêng của chúng, vì thế khi các nguyên tố được tôi luyện từ từng nucleon, khối lượng dôi dư này được giải phóng thành “năng lượng liên kết”. Các phản ứng hạt nhân có thể bòn rút nguồn năng lượng này hoặc qua sự nhiệt hạch (kết hợp các hạt nhân nhẹ thành hạt nhân nặng hơn), hoặc phân hạch (phân tách các nguyên tố nặng thành những mảnh nhẹ hơn).
Năng lượng liên kết tăng khi số nucleon tăng thêm, tạo ra các hạt nhân nguyên tử càng bền hơn lên tới cực đại tại Ni-62. Năng lượng liên kết hạt nhân lớn gấp khoảng một triệu lần so với năng lượng liên kết electron của các nguyên tử.
Bảng tuần hoàn hóa học tốc hành | Dan Green