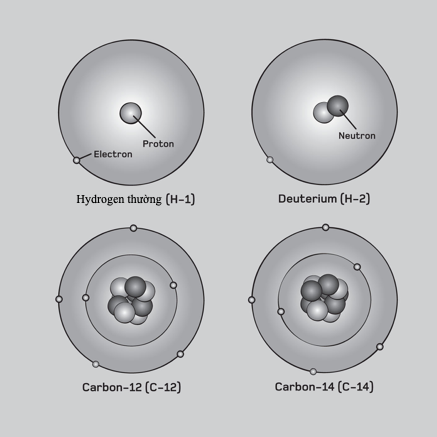
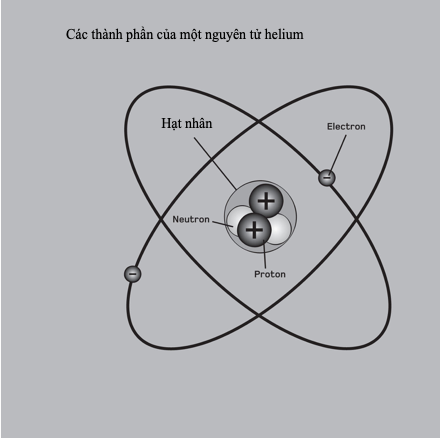
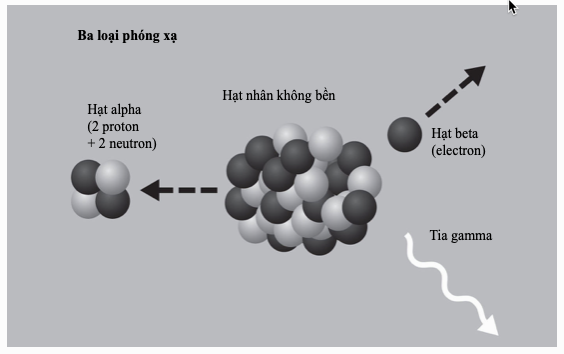
Liên kết kim loại
Một loại liên kết thứ ba ở các hợp chất là liên kết kim loại. Người ta thường nói loại liên kết này là tiêu biểu của các kim loại. Nói cho đúng hơn, chính tính chất của các nguyên tố kim loại phát sinh từ xu hướng của chúng hình thành những liên kết này. Sự liên kết trong các kim loại có đặc trưng của liên kết ion lẫn liên kết cộng hóa trị. Thay vì gắn liền với một nguyên tử nhất định nào đó, các electron hóa trị tự do di chuyển xung quanh nhiều “lõi nguyên tử” tích điện dương.
Lực hút tĩnh điện tạo nên chất rắn làm nhớ tới liên kết ion, còn các electron “phi định xứ” được “chia sẻ” giữa các nguyên tử trong các orbital chồng lấn, giống như trong liên kết cộng hóa trị. Mỗi lõi tích điện dương không phải một ion, mà gồm hạt nhân nguyên tử và toàn bộ các electron không có mặt trong lớp vỏ ngoài. Loại liên kết này rất mạnh và cần năng lượng lớn để phá vỡ – đây là lí do vì sao các kim loại, nói chung, có điểm nóng chảy và điểm sôi cao. Nó còn cho phép các kim loại có độ dẻo cao, không giống như tính rắn giòn của các hợp chất ion hay cộng hóa trị.
Các electron dùng giữa các ion tích điện dương đem lại một mạng tinh thể kim loại, trong đó các electron tự do dịch chuyển và dẫn điện.
Phản ứng hóa học
Sách giáo khoa phổ thông giải thích phản ứng hóa học là sự biến đổi một chất này thành chất khác. Định nghĩa được sử dụng rộng rãi này xét đến rất nhiều kiểu biến đổi xảy ra trong tự nhiên, nhưng nó không cung cấp bất kì manh mối nào cho biết làm thế nào hay tại sao các thứ phản ứng với nhau, và cái gì xác định các sản phẩm.
Phản ứng hóa học thường ám chỉ các tương tác liên quan đến các electron hóa trị – phá vỡ các liên kết giữa các chất và tạo ra những liên kết mới. Điều này bao quát vô số biến đổi từ những kết hợp đơn giản, đến thay thế từng nguyên tử hay các nhóm. Phá vỡ các liên kết hóa học đòi hỏi năng lượng, và một phản ứng sẽ diễn tiến tự phát nếu các liên kết mới giải phóng năng lượng nhiều hơn khi chúng hình thành. Ngược lại, sự biến đổi hóa học đòi hỏi phải cấp năng lượng. Tuy nhiên, các chất xúc tác làm hạ năng lượng đòi hỏi cho một phản ứng hoặc cho phép nó diễn ra nhanh hơn. Việc xem xét năng lượng phản ứng cho phép người ta dự đoán và khống chế các phản ứng, và thực hiện các quá trình tổng hợp gồm nhiều bước.

Pháo hoa là một loạt phản ứng hóa học phức tạp: các màu sắc được tạo ra bởi phản ứng cháy của các muối kim loại.
Bảng tuần hoàn hóa học tốc hành | Dan Green