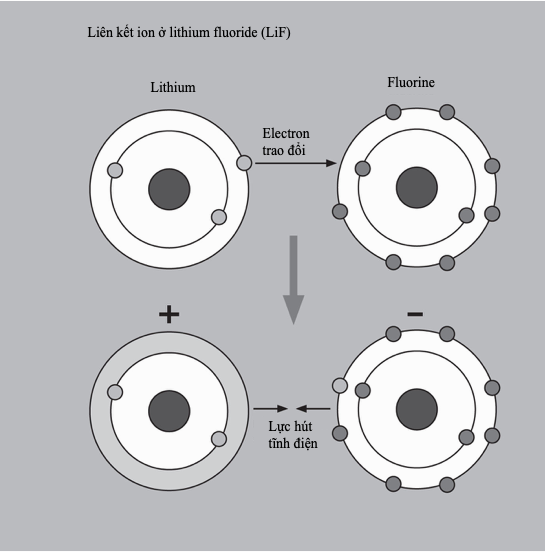
Liên kết ion
Liên kết ion là một loại liên kết hóa học trong đó các ion tích điện trái dấu tạo thành các chất rắn kết tinh. Nó còn được gọi là liên kết điện hóa trị bởi vì các nguyên tử sẽ thường xuyên “trao đổi” electron để hoàn chỉnh các lớp vỏ hóa trị của chúng và đạt được một cấu hình bền. Các ion thu được tạo thành các hợp chất liên kết với nhau bằng lực hút tĩnh điện.
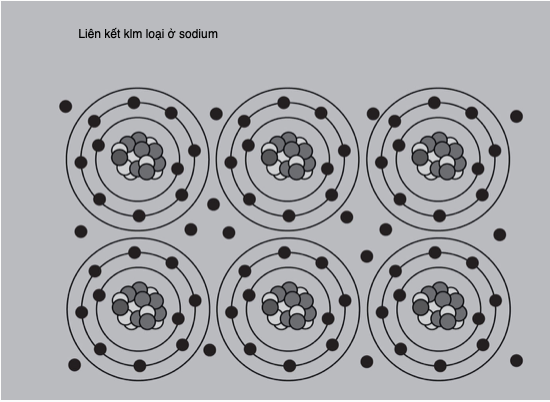
Liên kết ion thường hình thành giữa các cation kim loại và anion phi kim. Một ví dụ kinh điển là sodium liên kết với chlorine tạo thành sodium chloride (NaCl). Một nguyên tố có độ âm điện càng lớn, thì bản chất của liên kết càng mang tính ion. Tuy nhiên, với các hợp chất ion cũng thường có một đặc tính cộng hóa trị (chia sẻ electron) nào đó. Ngoài các ion riêng lẻ, các phân tử liên kết cộng hóa trị, ví dụ như carbonate (CO32-) có thể tạo thành các ion đa nguyên tử. Các ion xếp chặt vào những không gian nhỏ nhất có thể, hình thành nên một mạng tinh thể gồm các đơn vị lặp lại tuần hoàn. Các hợp chất ion thường có điểm nóng chảy cao và ở dạng rắn của chúng thường giòn và có xu hướng không dẫn điện.
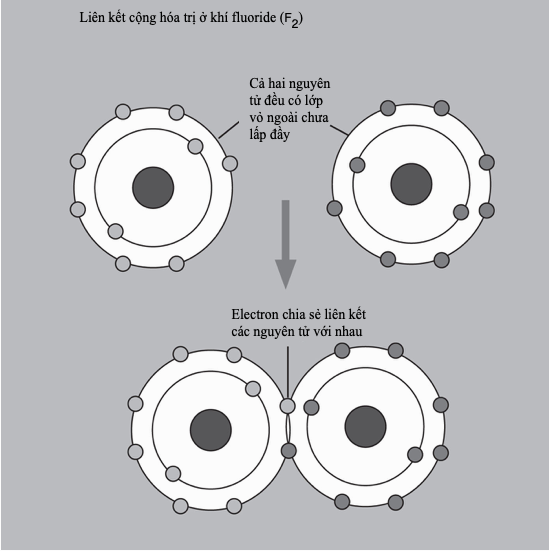
Liên kết cộng hóa trị
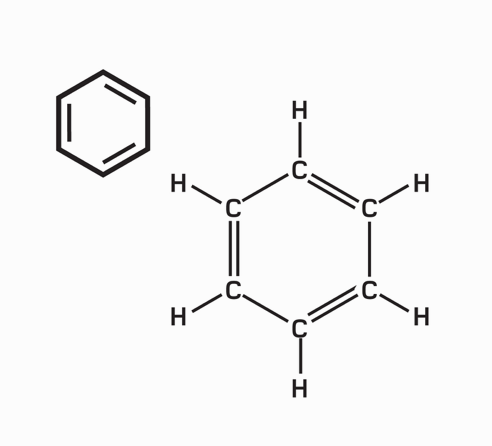
Liên kết cộng hóa trị là một mô hình liên kết hóa học trong đó các electron được “dùng chung” chứ không hoán đổi. Các nguyên tử sẽ “tìm cách” lấp đầy lớp vỏ ngoài cùng của chúng để đạt một cấu hình electron bền hơn. Ví dụ, bốn nguyên tử hydrogen, mỗi nguyên tử gồm một electron và “không gian” cho một electron nữa trong lớp vỏ ngoài cùng, có thể liên kết với một nguyên tử carbon – mang bốn electron lớp vỏ ngoài, nhưng có đủ chỗ cho tám electron trong lớp vỏ hóa trị của nó – tạo thành methane (CH4).
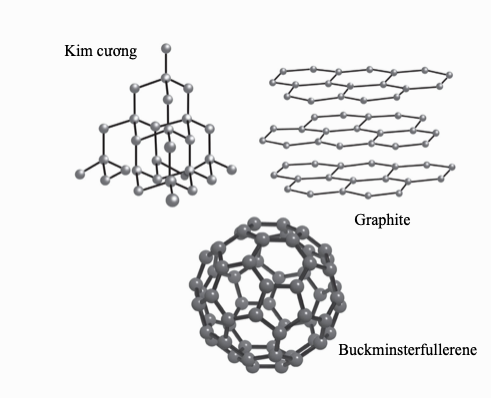
“Chia sẻ” electron cho phép nhiều tùy chọn liên kết đa dạng. Nhiều nguyên tử chia sẻ nhiều hơn một electron để tạo thành liên kết đôi và liên kết ba. Các hợp chất cộng hóa trị chủ yếu hình thành giữa các phi kim, và bởi vì ít có cơ hội cho điện tích dịch chuyển khi mà các electron đã bị giam chặt, nên chúng thường là chất cách điện. Các phân tử trung hòa chịu lực hút tương hỗ nhỏ, thành ra nhiều hợp chất như thế là chất khí và chất lỏng điểm sôi thấp, ví dụ như carbon dioxide và pentane. “Các phân tử vĩ mô” lớn liên kết cộng hóa trị trong ba chiều, tạo thành các chất rắn cứng, điểm nóng chảy cao, ví dụ như kim cương.
Bảng tuần hoàn hóa học tốc hành | Dan Green