Thách thức phía trước
Như vậy, bảng tuần hoàn của Mendeleev là lần đầu tiên một sơ đồ phân loại hóa học được sử dụng để dự đoán các nguyên tố chưa biết, và lòng tin của người Nga vào sơ đồ cơ bản của ông tăng dần. Robinson rút ra một bản sao của bản dịch tiếng Anh đầu tiên của quyển Các nguyên lí Hóa học của ông, nó được xuất bản năm 1891 và dịch theo bản in tiếng Nga lần thứ năm, do Mendeleev hiệu đính. Bảng tuần hoàn trong bản in đó có rất nhiều ô trống chưa có tên khác, trong đó có ô mà radium (Ra) sẽ được tìm thấy 20 năm sau này. “Chủ đề chính của công trình này,” Mendeleev viết trong lời nói đầu, là “các nguyên lí triết học” của hóa học. Trong đó, ông cố gắng “gạt đi những ảo tưởng cổ điển”, và trình bày nội dung kiến thức “không những đem lại sự dễ chịu về mặt tinh thần mà còn hữu ích trên thực tiễn”. Ông cho biết nội dung trình bày của ông dựa trên “quy luật tuần hoàn” của các nguyên tố hóa học và quả quyết rằng bảng tuần hoàn của ông đưa chúng “vào hàng, vào nhóm, và chu kì”. Phiên bản này của bảng tuần hoàn na ná bảng mà Robinson cho tôi xem trước đó, nhưng với các nguyên tố được đảo ngược lại.
Các nguyên tố phóng xạ còn khó hiểu vì những lí do khác. Có vẻ như chúng báo hiệu sự tồn tại của các chất có hóa tính khác nhau lại trông như thể chúng chiếm cùng một vị trí trên bảng tuần hoàn, và các chất có hóa tính giống nhau nhưng trông như thể chúng chiếm giữ hai chỗ khác nhau. “Người ta không cho rằng các nguyên tố lại như thế,” Robinson nói. “Người ta cho rằng mỗi nguyên tố chiếm một ô thôi!” Song nếu các nguyên tố phóng xạ thách thức các quan niệm ban đầu về bảng tuần hoàn, thì nó cũng dọn đường cho việc khám phá các nguyên tố mới thuộc loại này.
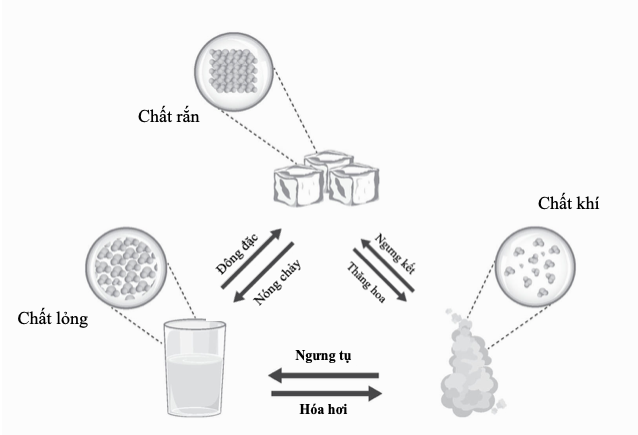
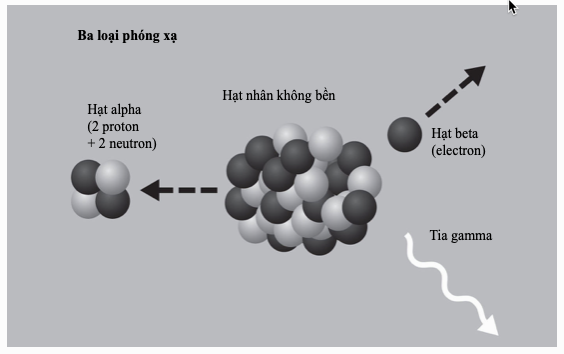
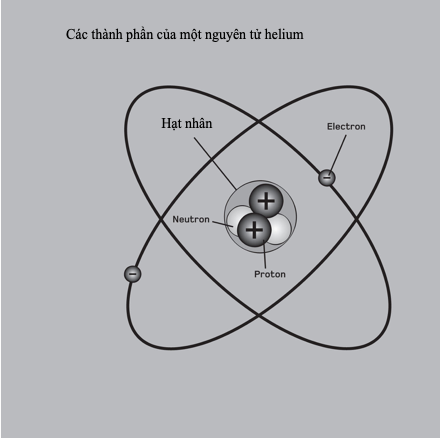
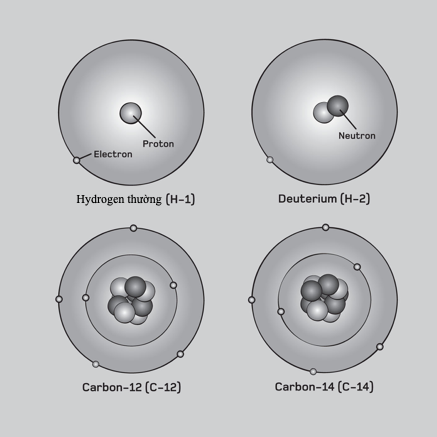
Đến năm 1914, mọi thứ được làm sáng tỏ. Ernest Rutherford khám phá hạt nhân nguyên tử ba năm trước đó, và – nhờ quan niệm của cơ học lượng tử – Niels Bohr đã làm cho mô hình của Rutherford vận hành được. Sau đó Frederick Soddy chứng minh sự tồn tại của các đồng vị: các nguyên tử thuộc một nguyên tố nhất định có cùng số proton nhưng khác số neutron. Khái niệm ấy giải quyết được vấn đề vị trí, vì tất cả các đồng vị của một nguyên tố có thể bố trí chung một ô trên bảng tuần hoàn, với trọng lượng nguyên tử của nguyên tố đó – cái ngày nay gọi là khối lượng nguyên tử tương đối – là khối lượng trung bình của tất cả các nguyên tử của nguyên tố đó, xét theo hàm lượng tương đối của chúng. Các nghiên cứu tia X của Henry Moseley cho thấy “số nguyên tử” của một nguyên tố không phải là một con số tùy tiện mà nó gắn liền với một tính chất nhất định có thể đo được của hạt nhân nguyên tử. Đó chính là số proton trong mỗi nguyên tử và vì thế đó chính là vị trí của nó trên bảng tuần hoàn khi các nguyên tố được sắp xếp theo trọng lượng nguyên tử.
Công trình của Moseley đổ thêm bê tông củng cố cho sơ đồ của Mendeleev, ngoài ra nó còn xác nhận dứt khoát tính hợp lệ của việc đặt tellurium (52 proton) lên trước iodine (53 proton) trên bảng tuần hoàn. Thế nhưng sự ưu việt tăng dần của số nguyên tử so với trọng lượng nguyên tử, Robinson nói, khiến các nhà hóa học e ngại rằng vật lí học đang lấn át vai trò của họ trong việc mô tả các nguyên tố.
Con đường đưa đến vinh quang
Trong luận án tiến sĩ của cô, Robinson lần theo câu chuyện xảy ra tiếp sau đó. Sau năm 1869, nhiều nhà hóa học đã sáng tạo ra nhiều phiên bản của bảng tuần hoàn Mendeleev, và các thầy giáo nhận ra tính hữu ích của các bảng như thế. Các quyển giáo trình đầu tiên bao gộp bảng tuần hoàn được xuất bản trong thập niên 1870, song phiên bản đầu tiên của bảng tuần hoàn quen thuộc nhất mãi đến năm 1923 mới xuất hiện khi nhà hóa học Mĩ Horace G Deming xuất bản một quyển giáo trình tựa đề là Hóa học đại cương: Một khảo sát sơ bộ nhấn mạnh các ứng dụng công nghiệp của các nguyên lí cơ bản.
Robinson cho tôi xem bản in lần thứ hai quyển sách của Deming, nó không nhắm vào các nhà nghiên cứu hàn lâm. “Nó hướng đến đối tượng sinh viên không nhất thiết đào sâu về hóa học, hay những người sẽ ra làm công nghiệp,” cô ta giải thích. Quyển sách gây tiếng vang lớn và qua sáu lần xuất bản – lần cuối vào năm 1952 – phổ biến phiên bản hiệu đính của Deming cho bảng tuần hoàn Mendeleev. Các công ty hóa chất cũng bắt đầu sử dụng nó trong tài liệu của họ và, vào năm 1928 gã khổng lồ dược phẩm Mĩ Merck thu nhỏ bảng tuần hoàn lại và phát hành nó với cỡ giấy viết thư và cỡ card danh thiếp. Vào năm 1934, nó là bảng tuần hoàn đầu tiên được đưa vào Sổ tay CRC về Hóa học và Vật lí học – một cuốn sổ tay tham khảo chuẩn. “Các sự kiện như thế đã biến nó thành bảng,” Robinson nói. “Nó là một hệ thống thực dụng cực kì hữu ích trong giảng dạy hóa học.” Thật vậy, điểm mấu chốt trong luận án của cô đó là “trong sự phát triển về hình thức của bảng tuần hoàn, tính sư phạm giữ vai trò quan trọng hơn là nghiên cứu”.
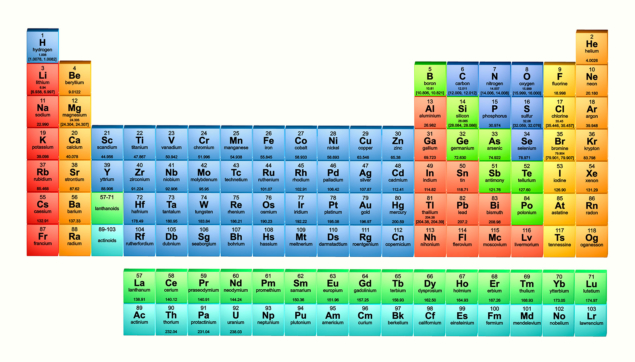
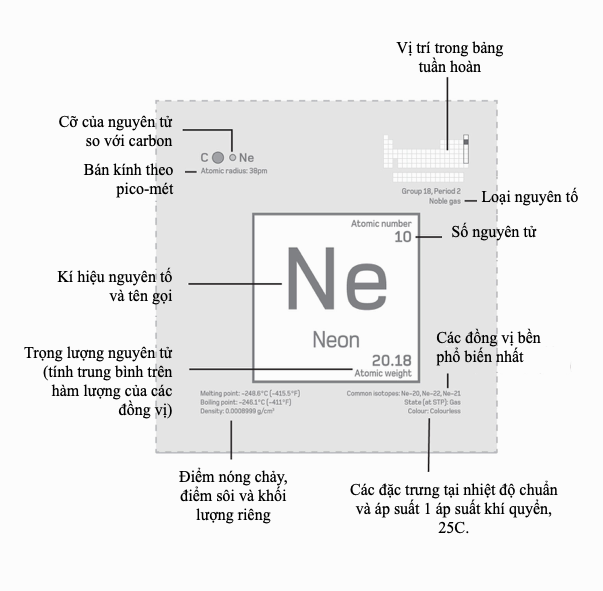
Bảng tuần hoàn hóa học ngày nay (tính đến tháng Năm 2017) bao gồm 118 nguyên tố đã biết, với những bổ sung mới đây nhất là nihonium (nguyên tố 113), moscovium (115), tennessin (117), và oganesson (118). Phiên bản này được lập mã màu để thể hiện các nguyên tố các tính chất giống nhau. Các nguyên tử không có trọng lượng nguyên tử được liệt kê trong bảng là các nguyên tố không bền. (Ảnh: Alfred Pasieka/Science Photo Library)
Bảng tuần hoàn tỏ ra đủ linh hoạt để tồn tại song hành cùng sự khám phá, trong hơn 25 năm qua, về các nguyên tố có số nguyên tử trên 110, lấp đầy những khoảng trống còn lại trên hàng thứ bảy của bảng. “Một trong những đặc điểm hay nhất của bảng tuần hoàn,” Robinson nhắc nhở tôi, “đó là sự linh hoạt của nó, khả năng của nó chứa đựng các nguyên tố mà Mendeleev sẽ không bao giờ ngờ tới, ví dụ như các nguyên tố tổng hợp.”
Thế nhưng bảng tuần hoàn, dù của Mendeleev hay của ai khác, không giải quyết được một vấn đề. Vâng, rốt cuộc, nguyên tố là gì? Đó là một ví dụ về một vấn đề khoa học không thể nào giải quyết được bằng cách nghiên cứu nhiều hơn, mà nó đòi hỏi sự phản tỉnh về những nguyên lí cơ bản chỉ dẫn cho lí thuyết và thí nghiệm. Việc trả lời những câu hỏi như thế rơi vào địa hạt của triết lí khoa học. Thật vậy, một số triết gia từng tự hỏi rằng các nguyên tố “siêu nặng” tại đầu cuối của bảng tuần hoàn (các nguyên tố có trọng lượng nguyên tử 104 và lớn hơn) thật sự có thể được gọi là các nguyên tố hay không. Biết rằng chúng không được tìm thấy trong tự nhiên, mà chỉ có thể được tạo ra trong phòng thí nghiệm và phân hủy hầu như tức thời, chúng còn làm phát sinh những câu hỏi nghiêm túc rằng chúng có “tồn tại” hay là không.
Một vấn đề triết lí nữa mà bảng tuần hoàn làm nảy sinh đó là ranh giới giữa vật lí học và hóa học. Phải chăng mỗi nguyên tố là một hình thái của cái gì đó có các đơn vị cơ bản chia sẻ cấu trúc giống nhau, đó là cách các nhà vật lí nghĩ về chúng? Hay mỗi nguyên tố là cái gì đó có các tính chất như màu sắc và hương vị có thể làm được thí nghiệm trên đó – tức quan điểm của nhà hóa học? Các nhà vật lí thường hình dung các nguyên tố là những thứ vô hình không thể nhìn thấy được và vẫn không đổi khi kết hợp, trong khi các nhà hóa học nghĩ về các nguyên tố của họ là những chất có thật bạn có thể cầm nắm trong tay mình, giống như một miếng tungsten vậy. Cả quan điểm của nhà vật lí lẫn nhà hóa học đều có vẻ cần thiết cho khái niệm về một nguyên tố, mặc dù chúng liên quan đến những bức tranh khác nhau. Mendeleev từng gặp phải vấn đề này, và những người theo sau ông thường cố gắng giải quyết nó với những kiểu phân biệt như chất tinh khiết và chất đơn giản, hay nguyên tố hóa học và chất sơ cấp. Các phân biệt như thế thể hiện sự phân chia trên phương diện thực hành giữa hóa học và vật lí học.
Vấn đề ấy tồn tại cho đến ngày nay, ngay cả IUPAC cũng không đưa ra quan điểm rạch ròi. Trích yếu Thuật ngữ Hóa học do IUPAC phát hành – thường được gọi là Sách Vàng do màu bìa sách – đưa ra không phải một mà đến hai định nghĩa về nguyên tố. Định nghĩa thứ nhất nói một nguyên tố là “tất cả các nguyên tử có cùng số proton trong hạt nhân nguyên tử”, còn định nghĩa thứ hai nói nó là “một hóa chất tinh khiết gồm các nguyên tử có cùng số proton trong hạt nhân nguyên tử”. 150 năm sau bảng tuần hoàn đầu tiên của Mendeleev, thực tế sự phân biệt này vẫn còn tồn tại, đối với Robinson, là một phản ứng trước khi sự xâm lấn của vật lí học vào hóa học. “Nhà vật lí các anh có thể mặc sức chơi đùa với các nguyên tố của chúng tôi như các anh muốn,” cô ta cảnh báo. “Thế nhưng vẫn có một nguyên tố hóa học ở đó mà các anh không thể nào lấy đi được!”
123physics dịch từ tạp chí Physics World, tháng 2/2019