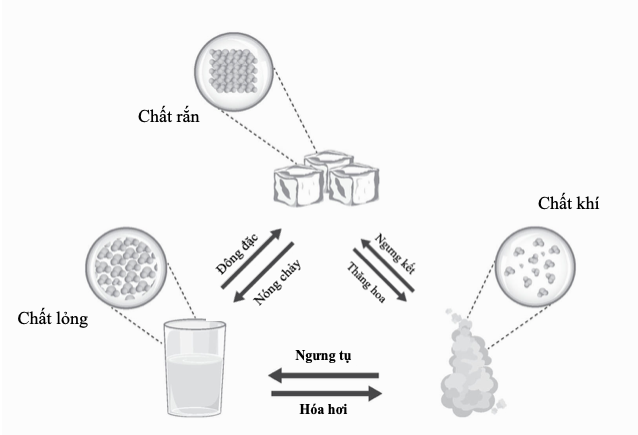
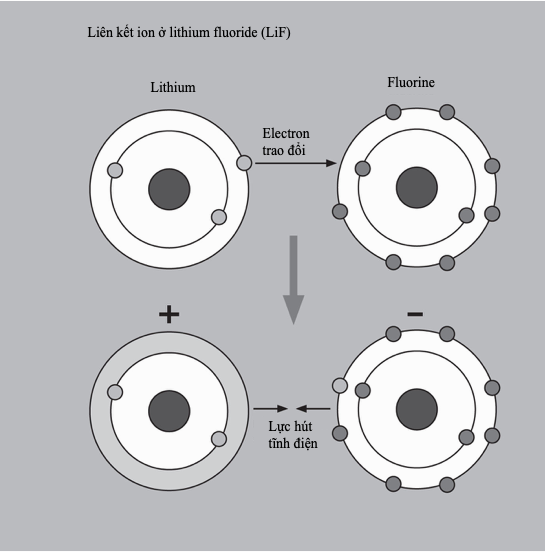
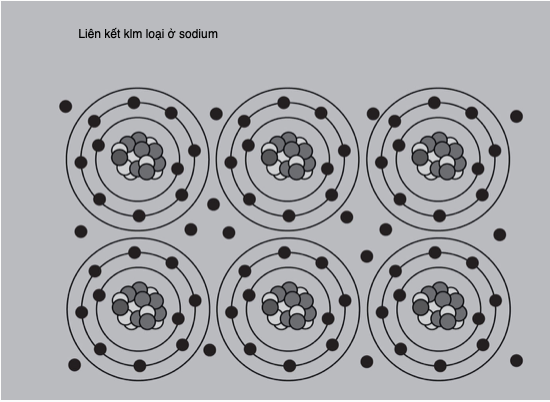
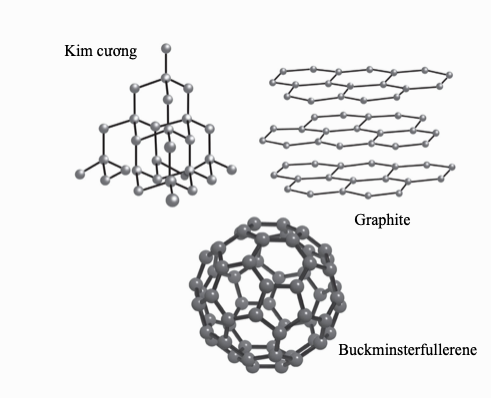
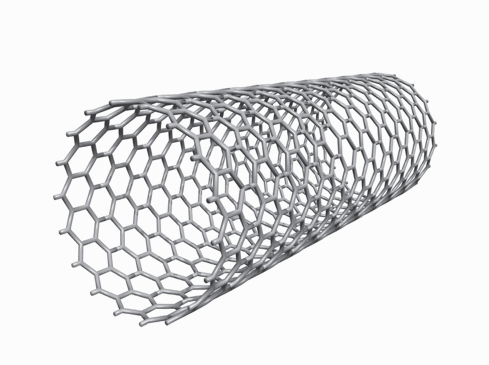
Các kim loại nặng có độc tính
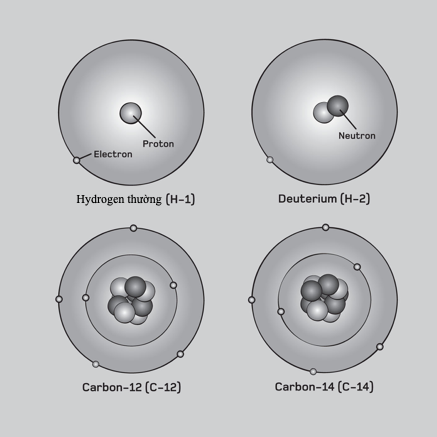
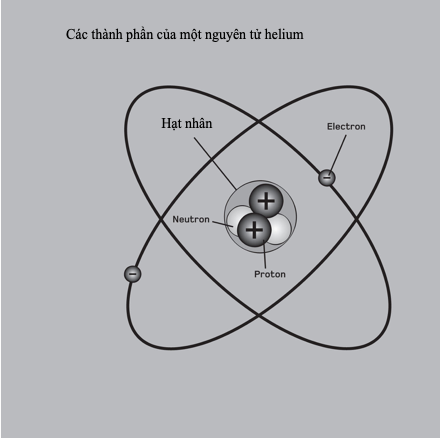
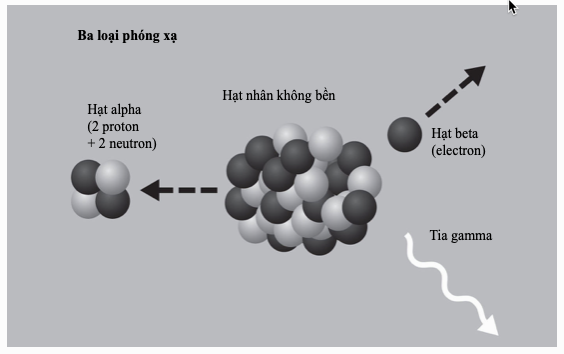
Kim loại nặng là bất kì kim loại hay á kim tỉ trọng cao nào có độc tính đối với cơ thể người ở hàm lượng thấp. Chì, thủy ngân, cadmium và arsenic có lẽ là độc nhất trong số những chất gây ô nhiễm môi trường này. Mặc dù nhiều kim loại nặng khan hiếm trên Trái Đất, song chúng tích tụ đến mức độc hại thông qua khai khoáng và công nghiệp, và chất thải mà những hoạt động này tạo ra.
Hoạt động khai khoáng thường sử dụng các kim loại nặng để trích xuất các kim loại quý. Chúng trở nên tập trung trong các phế phẩm và ao đọng, rồi thấm vào đất hoặc thoát vào các dòng chảy. Than đá cũng chứa các kim loại nặng, chúng được phóng thích vào không khí khi bị đốt hoặc gom lại thành muội than. Trong pin có chứa chì, cadmium và nickel, trong khi sự nhiễm độc arsenic tự nhiên đối với nước ngầm là một vấn đề trọng yếu ở nhiều nơi thuộc châu Á, Nam Mĩ và nước Mĩ. Các kim loại nặng làm loạn hóa học cơ thể, bám lấy các phân tử sinh học và ngăn chúng hoạt động đúng chức năng. Chúng tích tụ trong mô thực vật và động vật, gây nên những mức nguy hại trong chuỗi thức ăn.

Nhóm boron
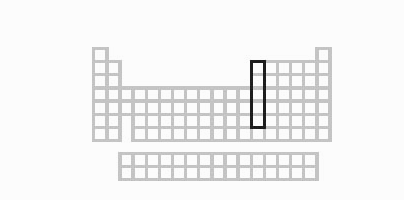
Boron không giống ai trong gia đình nguyên tố của nó. Các nguyên tố kia – nhôm, gallium, indium và thallium – nói chung đều kim loại mềm, yếu, có ánh bạc. Boron, trái lại, là một á kim cứng. Trong khi boron hầu như kém hoạt tính, thì các thành viên kia của nhóm 13 dễ dàng kết hợp với các nguyên tố khác. Gia đình boron của các nguyên tố thường được tìm thấy trong các quặng mỏ và khoáng chất – nhôm là nguyên tố dồi dào thứ ba trong lớp vỏ Trái Đất. Cả nhóm đều có ba electron trong lớp vỏ ngoài cùng của chúng, và thỉnh thoảng được gọi là ‘triel’ hay ‘icosagen’. Tính kim loại của các nguyên tố và độ hoạt động của chúng tăng từ trên xuống dưới nhóm. Bởi thế, trong khi indium và thallium là kim loại đích thực, thì nhôm và gallium sẽ hình thành liên kết ion lẫn liên kết cộng hóa trị. Xu hướng này, cũng thấy ở các nhóm 14, 15 và 16, có thể giải thích bởi kích cỡ tăng dần của các nguyên tử trong nhóm: các electron ngoài cùng của boron bị giữ chặt với hạt nhân, làm giảm kích cỡ và hoạt tính của nó, còn các electron hóa trị của các nguyên tử nặng hơn được chắn với hạt nhân bởi các lớp vỏ electron phía trong, khiến chúng lớn hơn và có hoạt tính hơn.

Tinh thể alum (potassium nhôm sulfate).
Bảng tuần hoàn hóa học tốc hành | Dan Green
Bản dịch của Thuvienvatly.com