Pauli bắt đầu xem xét một hình ảnh nhắc ông tới bảng tuần hoàn các nguyên tố. Các chất khí trơ helium, neon, argon, krypton, xenon, và radon có 2, 10, 18, 36, 54, và 86 electron, tương ứng với các mức năng lượng đã lấp đầy lên tới những giá trị n/k nhất định. Helium, chẳng hạn, có hai electron n = 1/k = 0, một với spin up và một với spin down. Neon là helium cộng thêm các electron n = 2. Argon là neon cộng thêm các electron n = 3 với k = 0 hoặc 1, và cứ thế. Người ta có thể xem những chất khí trơ này là những lớp vỏ kín gồm các electron đã ghép cặp. Những nguyên tố khác có các electron nằm bên ngoài những lớp vỏ lấp kín đó, cái xác định hóa trị và ảnh hưởng đến cách thức chúng hình thành nên những hợp chất và tinh thể. Thí dụ, các kim loại kiềm (sodium, potassium, rubidium, cesium, francium) đều có nhiều hơn lớp vỏ kín một electron và hành xử rất giống nhau trong các tương tác hóa học. Tương tự, các phi kim halogen (fluorine, chlorine, bromine, iodine, và astatine) thiếu một electron để có lớp vỏ kín.
Như vậy, những đổi mới của Pauli về số lượng tử spin, s, và nguyên lí loại trừ làm được nhiều việc hơn là giải thích các hiệu ứng từ, ví dụ như hiệu ứng Zeeman dị thường và thí nghiệm Stern-Gerlach. Chúng còn làm sáng tỏ một câu đố cũ đã nửa thế kỉ tuổi; chúng là định luật tự nhiên chi phối hành trạng tuần hoàn của các nguyên tố. Với những sự tinh chỉnh của Sommerfeld và Pauli, mô hình nguyên tử Bohr đã đi một chặng đường dài. Tuy nhiên, nhiều nhà vật lí vẫn gặp rắc rối bởi một bài toán chính chưa được giải trong thuyết lượng tử, vấn đề đã ám ảnh họ kể từ khi Rutherford lần đầu tiên đề xuất mẫu hành tinh nguyên tử. Theo hệ phương trình Maxwell, các electron đang quay tròn sẽ phát ra sóng điện từ. Tại sao yêu cầu đó lại bị loại trừ với những quỹ đạo nhất định? Tương tự, bản thân nguyên lí loại trừ có vẻ như tùy tiện. Bằng chứng quang phổ cho thấy rõ ràng rằng không có hai electron nào có thể chiếm cùng một trạng thái lượng tử, nhưng không có điểm nào trong lí thuyết đề xuất tại sao nó phải như thế cả.
Để trả lời câu hỏi bức xạ, họ chuyển sang một ý tưởng mang tính cách mạng dược đề xuất vào năm 1924 bởi chàng trai trẻ người Pháp tên là Louis de Broglie (1892–1987). De Broglie bắt đầu bởi việc lưu ý rằng nền vật lí gần đây đã chịu một sự giải thích lại triệt để về bản chất của năng lượng điện từ (ví dụ như ánh sáng). Trong hàng thế kỉ, người ta đã đi tìm câu trả lời cho một câu hỏi: Ánh sáng là sóng hay là một dòng hạt? Thí nghiệm nổi tiếng năm 1801 của Young đã thuyết phục họ rằng ánh sáng là một hiện tượng sóng, và hệ phương trình Maxwell cho thấy sóng ánh sáng truyền là sóng điện từ. Quan điểm đó vẫn vững chắc mãi cho đến những năm áp cuối của thế kỉ 19, khi phát minh toán học của Planck – lượng tử – cho thấy ánh sáng có bản chất hạt. Không lâu sau đó, việc khám phá ra hiệu ứng quang điện đã đưa Einstein đến chỗ tuyên bố rằng câu trả lời cho câu hỏi là-cái-này-hay-cái-kia về ánh sáng là “cả hai”.
Nếu như các sóng điện từ, ví dụ như ánh sáng, có thể hành xử giống như những dòng hạt, thì những hạt đó có mang xung lượng cũng như năng lượng hay không? Thuyết tương đối Einstein nói là có, nhưng đến năm 1923 thì xung lượng của lượng tử ánh sáng mới được quan sát thấy trong một thí nghiệm. Nhà vật lí người Mĩ Arthur Holly Compton (1892–1962; giải Nobel vật lí 1927) đang nghiên cứu một chùm tia X hẹp truyền qua các khối graphite. Toàn bộ tia X tới có tần số bằng nhau, nhưng tia X đi ra thì không. Graphite đã làm phân tán chùm tia, và tia X đi ra có tần số thấp hơn tia X tới. Chùm tia X bị tán xạ ra khỏi hướng ban đầu của nó càng xa thì độ giảm tần số của nó càng lớn. Nó giống như thể là ông chiếu ánh sáng tím đơn sắc qua một miếng thủy tinh và tạo ra một phổ phân tán với màu tím ở chính giữa và các dải màu phân tán ra phía ngoài bắt đầu với màu lam, tiến triển qua màu lục, vàng, cam, và cuối cùng đạt tới màu đỏ ở ngoài cùng.
Tia X rõ ràng đang bị tán xạ khỏi cái gì đó và lấy của nó nhiều năng lượng hơn khi góc tán xạ lớn hơn. Vậy thì chúng tương tác với cái gì trong graphite, và chúng tương tác như thế nào? Compton quả quyết rằng tương tác đó có thể xem là sự va chạm giữa hai hạt, một lượng tử tia X đang chuyển động ở tốc độ ánh sáng và một electron đang chuyển động chậm hơn rất nhiều nên ông có thể xem là nó đang đứng yên. Đối với lượng tử tia X, ông sử dụng năng lượng cho bởi định luật Planck và xung lượng do thuyết tương đối tiên đoán. Sau đó, ông áp dụng các nguyên lí bảo toàn xung lượng và năng lượng để tính ra mối liên hệ giữa năng lượng của lượng tử đi ra và hướng của nó. Kết quả của ông phù hợp với cái ông trông thấy trong thí nghiệm của ông. Như vậy, thí nghiệm Compton đã chứng minh rằng lượng tử ánh sáng có năng lượng và xung lượng giống như bất kì loại hạt nào khác (Năm 1926, các nhà khoa học đang gọi lượng tử ánh sáng là photon, tên gọi do nhà hóa học người Mĩ Gilbert Lewis [1875–1946] đề xuất).
Với bản chất lưỡng tính sóng hạt của lượng tử ánh sáng đã được xác lập, de Broglie đề xuất rằng lưỡng tính sóng hạt tương tự cũng đúng đối với electron hay bất kì cái gì khác mà các nhà vật lí thường mô tả đặc trưng là các hạt. Sau đó, ông phát triển một lí thuyết sử dụng sóng electron để loại bỏ bài toán các quỹ đạo không bức xạ. Ông viết lại công thức Planck cho lượng tử ánh sáng ở một dạng thức khác. Công thức của ông liên hệ bước sóng với xung lượng của một lượng tử thay vì năng lượng của nó. Rồi ông áp dụng công thức đó cho các electron, và kết quả thật bất ngờ. Đối với nguyên tử hydrogen, chu vi của quỹ đạo electron có năng lượng thấp nhất của Bohr đúng bằng bước sóng của electron đó. Đối với quỹ đạo thấp nhất thứ hai, chu vi bằng hai bước sóng, và cứ thế. Chu vi của quỹ đạo thứ n của Bohr đúng bằng n lần bước sóng của một electron trong quỹ đạo đó.
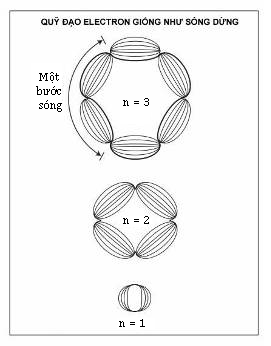
Louis de Broglie đã đưa các nhà vật lí đến một lộ trình mới khi ông mở rộng bản chất lưỡng tính sóng-hạt của ánh sáng cho đối tượng vật chất. Ông đề xuất rằng mỗi electron có một bước sóng phụ thuộc vào xung lượng của nó, và các quỹ đạo được phép của electron trong nguyên tử tương ứng với những sóng dừng tương tự các phách tạo ra bởi một nhạc cụ.
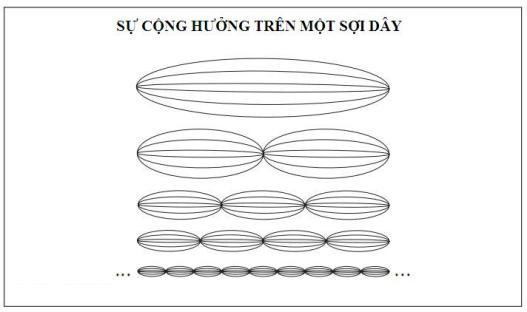
Nếu electron có các tính chất sóng, thì điều có ý nghĩa là các electron ở trong những quỹ đạo chứa toàn bộ những bước sóng. Tương tự như hiện tượng sóng dừng hoặc cộng hưởng phổ biến trong thế giới vật lí. Chẳng hạn, một thùng organ tạo ra một âm cơ bản tương ứng với một bước sóng bằng khoảng cách giữa hai đầu mở của nó. Nó còn tạo những họa âm mang lại âm sắc riêng của nó, một hỗn hợp các nốt có bước sóng ngắn hơn chính xác hai, ba, bốn lần, hoặc một số lần lớn hơn khoảng cách đó.
Nếu electron là sóng dừng thay vì một vật đang quay tròn, thì không cần phải duy trì vị trí của nó trong nguyên tử, và do đó nó không bị gia tốc. Không có gia tốc, thì chẳng có bức xạ. Ý tưởng của De Broglie đã loại trừ một phản bác nghiêm trọng đối với mẫu hành tinh nguyên tử, nhưng phải trả giá là thay thế các hạt electron bằng sóng electron. Đa số các nhà vật lí chống lại ý tưởng đó vì nó đi ngược lại trực giác của họ về cấu trúc hạt của vật chất. Tuy nhiên, họ vẫn chấp nhận bản chất lưỡng tính của ánh sáng vì các thí nghiệm của họ cho họ biết như thế. Trước khi hạ uy tín của giả thuyết De Broglie, họ biết đã đến lúc xem xem nó có thể dẫn tới cái gì.
Họ lần theo nó theo hai hướng: một lộ trình toán học và một lộ trình thực nghiệm. Năm 1926, nhà vật lí người Đức Erwin Schrödinger (1887–1961) tìm ra một cách xem xét các sóng. Thay vì mô tả vị trí của một hạt là một điểm trong không gian, ông mô tả nó là một hàm sóng. Hàm sóng là một biểu thức toán học khi vẽ ra là một tập hợp những gợn sóng đồng tâm xung quanh một điểm tròn trong không gian. Điểm đó sẽ là vị trí của vật nếu nó là một hạt. Nhưng những gợn sóng trải ra xung quanh điểm đó, hàm ý vật còn có sự hiện diện kiểu sóng, rộng hơn. Giống hệt như các định luật chuyển động của Newton và Einstein tiên đoán đường đi chính xác của một hạt, phương trình Schrödinger cho phép các nhà vật lí mô tả hàm sóng tương ứng và cách thức nó biến đổi theo thời gian.
Phương trình sóng tỏ ra rất thành công, và nhiều nhà vật lí đã thích nghi với cách giải thích hàm sóng loại bỏ sự khác biệt giữa hạt và sóng. Trong cách thức mới nhìn nhận vạn vật, hạt và sóng là như nhau, mặc dù người ta cảm nhận chúng khác nhau. Nếu hàm sóng bị phân tán, thì người ta thấy chúng dưới dạng sóng. Nhưng, vào cuối những năm 1920, cho dù người ta có cảm nhận chúng như thế nào, thì hành trạng của các hàm sóng đã biết tuân theo các định luật của một ngành vật lí mới gọi là cơ học lượng tử.

Erwin Schrödinger đã dựa trên lưỡng tính sóng-hạt de Broglie thiết lập nên một phương trình trung tâm của cơ học lượng tử. (Ảnh: AIP Meggers Gallery of Nobel Laureates)
Lịch sử vật lí thế kỉ 20 - Alfred B. Bortz
Bản dịch của Thuvienvatly.com
<< Phần trước | Phần tiếp theo >>