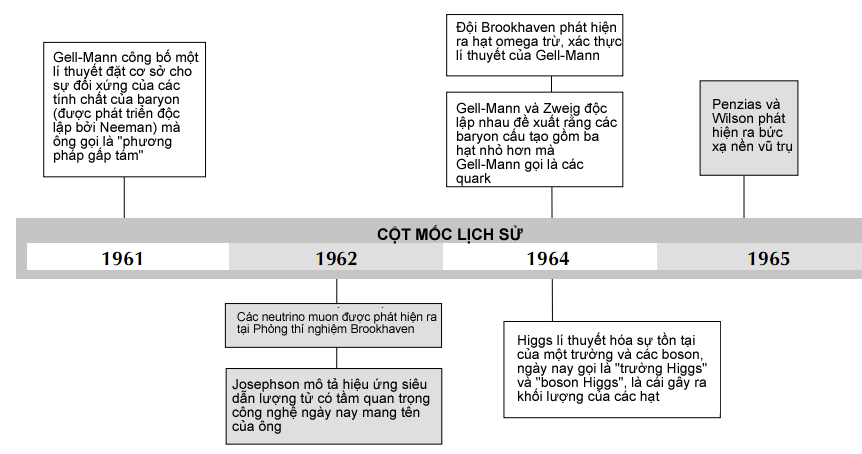
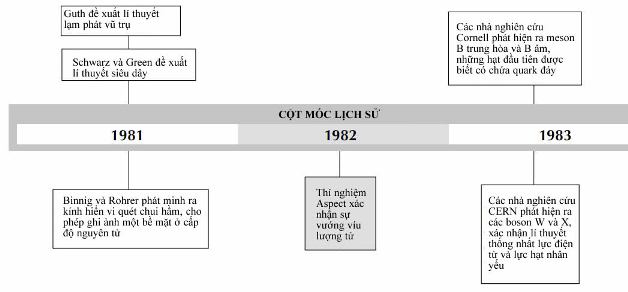
Từ nguyên tử Bohr đến cơ học lượng tử
Phần nhiều phát triển của cơ học lượng tử được chi phối bởi những nỗ lực tìm hiểu quang phổ vạch của những nguyên tố khác nhau. Thuyết nguyên tử của Bohr đã thành công rực rỡ trong việc dự đoán quang phổ hydrogen dưới những điều kiện bình thường, nhưng nó cần phải sửa đổi để giải thích hiện tượng tách vạch quang phổ. Thiết đặt điện trường và từ trường làm cho một số vạch trong quang phổ hydrogen tách thành những đám vạch, mỗi vạch có tần số hơi khác với vạch ban đầu. Khi cường độ trường ngoài tăng lên, thì độ dịch chuyển tần số trở nên lớn hơn.
Các quỹ đạo electron trong lí thuyết cơ bản của Bohr được mô tả bằng một số lượng tử, n, và tần số của một vạch cho trước trong quang phổ có thể được tính ra từ giá trị n của các quỹ đạo trước và sau bước chuyển tiếp của electron. Để giải thích sự tách vạch phổ, Arnold Sommerfeld (1868 – 1951), một giáo sư vật lí tại trường đại học Munich ở Đức, đã mở rộng mô hình electron của Bohr trong các nguyên tử theo một cách đặc biệt quan trọng. Theo trình tự thời gian, mở rộng của Sommerfeld thuộc về chương 2, vì ông đã thực hiện phần nhiều công việc này từ năm 1913 đến 1916, nhưng nó được kể ra ở đây để trình bày thống nhất sự đơm hoa kết trái của vật lí lượng tử. Sự đổi mới của Sommerfeld là thêm cái tương đương với định luật chuyển động hành tinh thứ nhất của Kepler vào lí thuyết Bohr: đó là quỹ đạo của chúng là những elip. Những quỹ đạo tròn, mà Bohr sử dụng trong các phép tính của ông, là trường hợp đặc biệt khi hai trục của elip bằng nhau.
Các phép tính của Sommerfeld xem n của Bohr là số lượng tử “chính”, và thêm một số lượng tử “phụ”, k, tương ứng với sự thuôn dài của elip. Đối với quỹ đạo tròn, k bằng không, nhưng lí thuyết Sommerfeld còn cho phép những giá trị lớn hơn của k và do đó cho phép những quỹ đạo thuôn dài hơn. Cơ sở toán học của ông cho phép các quỹ đạo elip được mô tả bởi những giá trị k là toàn bộ những số nhỏ hơn n. Chẳng hạn, thay vì có một quỹ đạo tròn đơn đối với n = 3, toán học Sommerfeld cho phép một vòng tròn đối với k = 0 và hai elip với độ thuôn dài tương ứng với k = 1 và k = 2. Ông sớm bổ sung thêm một số lượng tử “từ” thứ ba, m. Xem hạt nhân là một quả cầu có một trục nam-bắc, lí thuyết trên cho phép m nhận toàn bộ những giá trị số từ zero cho đến k. Các giá trị m tương ứng với những độ nghiêng khác nhau của quỹ đạo electron giữa cực và xích đạo. Giá trị của m dương hoặc âm, tùy thuộc vào quỹ đạo là cùng chiều hay ngược chiều kim đồng hồ khi nhìn từ phía trên cực bắc.
Khi không có điện trường hay từ trường ngoài, tất cả quỹ đạo electron trong nguyên tử hydrogen có cùng số lượng tử chính có năng lượng như nhau cho dù các giá trị k và m của chúng bằng bao nhiêu. Như vậy, thí dụ, tất cả electron rơi từ quỹ đạo với n = 3 xuống quỹ đạo với n = 2 tạo ra lượng tử ánh sáng có tần số như nhau. Nhưng khi có mặt điện trường, thì các năng lượng quỹ đạo, và do đó tần số của lượng tử ánh sáng thu được, phụ thuộc vào sự thuôn dài của quỹ đạo elip (đặc trưng bởi các giá trị k của chúng) trước và sau chuyển tiếp quỹ đạo. Điều đó mang lại kết quả là sự tách vạch phổ trong điện trường mạnh, một hiện tượng được quan sát thấy lần đầu tiên bởi nhà vật lí người Đức Johannes Stark (1874–1957) vào năm 1913 và đã không được giải thích thành công cho đến khi có những tính toán của Sommerfeld.
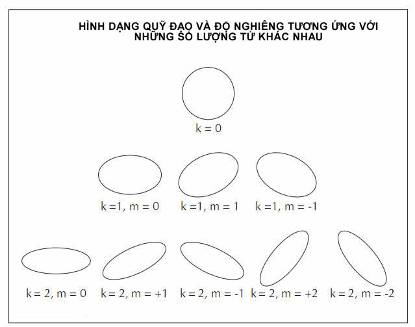
Để giải thích sự tách vạch phổ, Arthur Sommerfeld đã trau chuốt thuyết nguyên tử Bohr bằng cách thêm hai số lượng tử mới, ngoài số lượng tử chính n: số lượng tử phụ k tương ứng với sự thuôn dài của elip; và số lượng tử từ, m, tương ứng với góc trục dài của elip hợp với từ trường ngoài.
Số lượng tử từ giải thích cho sự tách vạch phổ trong từ trường, lần đầu tiên được chú ý tới bởi nhà vật lí người Hà Lan Pieter Zeeman (1865–1943) ở ánh sáng hơi natri vào năm 1896. Lí thuyết Bohr-Sommerfeld giải thích hiệu ứng Zeeman ở hydrogen như sau: Một electron đang quay tròn có thể xem là một vòng dây điện nhỏ xíu và do đó tác dụng giống như một nam châm điện. Hướng của quỹ đạo, cùng chiều hoặc ngược chiều kim đồng hồ (tương ứng với giá trị dương hoặc âm của m), xác định chiều định hướng của cực bắc và cực nam của nam châm điện nhỏ xíu đó. Khi có mặt từ trường ngoài, quỹ đạo cùng chiều kim đồng hồ có năng lượng khác với quỹ đạo giống hệt nhưng ngược chiều kim đồng hồ, vì nó nhận công để sắp thẳng hàng cực của nam châm điện với hướng của trường ngoài. Trường ngoài càng lớn thì sự khác biệt càng nổi trội. Hiệu ứng Zeeman còn là lớn nhất khi độ nghiêng mặt phẳng quỹ đạo của electron (tương ứng với các giá trị của m) là gần xích đạo nhất, và nhỏ nhất khi nó gần cực nhất.
Ba số lượng tử là đủ để giải thích đa số quang phổ vạch, nhưng vẫn còn đó những thách đố. Một trong số này là cái gọi là hiệu ứng Zeeman dị thường, trong đó từ trường phân tách các vạch phổ của một số nguyên tử thành nhiều nhánh hơn so với cái có thể giải thích bằng n, k, và m. Một kết quả còn gây ấn tượng hơn nữa phát sinh từ một thí nghiệm của các nhà vật lí người Đức Otto Stern (1888–1969) và Walther Gerlach (1889–1979) vào năm 1922. Họ cho một chùm nguyên tử bạc đi qua một từ trường mạnh dần từ dưới lên trên theo phương thẳng đứng. Nếu như tổng từ hóa của mỗi nguyên tử là tổng các giá trị m của tất cả 47 electron của nó, thì họ trông đợi từ trường sẽ làm phân trải chùm tia hẹp thành một dải rộng. Thay vì vậy, nó lại tách thành hai chùm, mỗi chùm hẹp như chùm ban đầu. Sự từ hóa của mỗi nguyên tử bạc rõ ràng là như nhau. Nếu nó sắp thẳng hàng với từ trường, thì các nguyên tử bị lệch theo một chiều; nếu nó sắp ngược lại với trường thì chúng bị lệch theo chiều ngược lại.
Một số nhà vật lí lí thuyết, đáng chú ý nhất là nhà vật lí gốc Áo Wolfgang Pauli (1900–58) tại trường đại học Hamburg, Đức, đã cố gắng giải thích kết quả đó. Năm 1924, Pauli đề xuất rằng từ tính của một electron không chỉ thu được từ chuyển động quỹ đạo của nó giống như một hành tinh quay xung quanh Mặt trời, mà còn từ “spin” của nó hay chuyển động quay xung quanh trục riêng của nó. Thí nghiệm Stern-Gerlach đề xuất rằng mỗi electron có một số lượng tử spin, s, có thể nhận giá trị + 1/2 và – 1/2, thường được hình dung là spin up và spin down. Trong một nguyên tử bạc, 46 trong số 47 electron trong nguyên tử bạc dường như tự nhóm lại thành 23 cặp up-down có sự từ hóa ngược nhau cộng lại bằng không. Electron còn lại sẽ cho nguyên tử spin toàn phần 1/2, nó có thể là up hoặc down.
Vào năm sau đó, Samuel Goudsmit (1902–78) và George Uhlenbeck (1900–88) thuộc trường đại học Leyden ở Hà Lan đã chứng minh bằng toán học rằng spin electron có thể giải thích được hiệu ứng Zeeman dị thường. Với bằng chứng không thể chối cãi rằng spin là một tính chất vật lí thật sự của các electron, Pauli đã đưa ra giả thuyết táo bạo sau đây về sự ghép cặp rõ ràng của các electron spin-up và spin-down trong một nguyên tử: Không có hai electron trong một nguyên tử có cùng một trạng thái lượng tử, nghĩa là có cùng bộ bốn số lượng tử (n, k, m, s) như nhau. Ông gọi đây là nguyên lí loại trừ, và nó đưa ông đến giành giải Nobel vật lí năm 1945. Theo lí thuyết Pauli, các electron trong một nguyên tử chiếm đầy các mức năng lượng dưới dạng các cặp spin-up/spin-down từ mức năng lượng thấp nhất đổ lên, bắt đầu với n = 1, k = 0, m = 0; rồi n = 2, k = 0, i = 0; rồi n = 2, k = 1, m = 0; rồi n = 2, k = 1, m = +/-1; và cứ thế. Mức năng lượng tiếp theo, với số lượng tử chính n = 2, chứa tới 8 electron. Mức n = 3 chứa 18 electron, 8 electron có k = 0 hoặc 1, và 10 electron có k = 2.
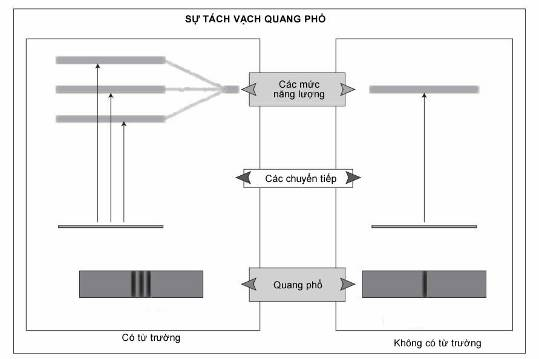
Khi có mặt điện trường hoặc từ trường, các mức năng lượng electron đối với mỗi giá trị của số lượng tử chính, n, tách thành tập hợp những mức năng lượng, mang lại tập hợp tương ứng các vạch phổ trong quang phổ nguyên tử. Một loại tách vạch phổi được gọi là hiệu ứng Zeeman dị thường vì nó không thể chỉ giải thích bằng các số lượng tử phụ và lượng tử từ, k và m. Nó khiến Wolfgang Pauli đề xuất ra tính chất của spin, số lượng tử tương ứng s của nó, và nguyên lí loại trừ giải thích bảng tuần hoàn các nguyên tố.
Lịch sử vật lí thế kỉ 20 - Alfred B. Bortz
Bản dịch của Thuvienvatly.com
<< Phần trước | Phần tiếp theo >>