Chúng tôi trích giới thiệu với các bạn một số bản dịch từ tác phẩm Những câu hỏi và bài tập vật lí phổ thông của hai tác giả người Nga L. Tarasov và A. Tarasova, sách xuất bản ở Nga năm 1968. Bản dịch lại từ bản tiếng Anh xuất bản năm 1973.
Các bài giảng được trình bày dưới dạng thảo luận hỏi đáp giữa giáo viên và học sinh.
§20. Các định luật chất khí (Phần 1)
GV: Hãy viết phương trình định luật chất khí kết hợp.
HS A: Phương trình này có dạng
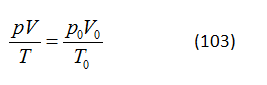
trong đó p, V và T là áp suất, thể tích và nhiệt độ của một lượng khí nhất định ở một trạng thái nhất định, và p0, V0 và T0 là áp suất, thể tích và nhiệt độ cho trạng thái ban đầu. Nhiệt độ được biểu diễn theo thang nhiệt độ tuyệt đối.
HS B: Em thích sử dụng một phương trình có dạng khác
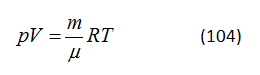
trong đó m là khối lượng của chất khí, μ là khối lượng của một phân tử gram và R là hằng số chất khí.
GV: Cả hai phương trình các em nêu đều đúng. (Quay sang HS B) Em sử dụng hằng số chất khí. Hãy nói xem em tính ra giá trị của nó như thế nào? Tôi không nghĩ là người ta có thể nhớ.
HS B: Để tính R, em có thể sử dụng phương trình (103), trong đó các thông số p0, V0 và T0 gán cho lượng khí đã cho nhưng xét ở điều kiện tiêu chuẩn. Điều này có nghĩa là p0 = 76 cmHg, T0 = 273 K và V0 = (m/μ) × 22,4 lít, vì một phân tử gram chất khí bất kì ở điều kiện tiêu chuẩn chiếm một thể tích xác định là 22,4 lít. Tỉ số (m/μ) rõ ràng là số phân tử gram có trong lượng khí đã cho. Thay những giá trị này vào phương trình (103) ta được
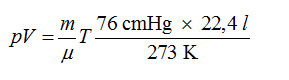
So sánh với biểu thức (104) ta được R = 6,2 cmHg.lít/độ.
GV: Tôi yêu cầu em làm những phép tính này là để chứng minh sự tương đương của biểu thức (103) và (104). Thật không may, các thí sinh thường chỉ biết phương trình (103) và không quen với phương trình (104), phương trình khớp với phương trình (102) thu được ở phần trước trên cơ sở xét các giả thuyết động học phân tử. So sánh phương trình (102) và (104) ta suy ra (m/μ)R = Nk. Như vậy
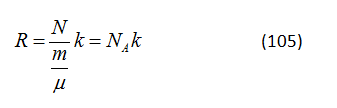
Vì thế, hằng số chất khí hóa ra là tích số của số Avogadro và hằng số Boltzmann.
Tiếp theo chúng ta sẽ xem các em có biết sử dụng phương trình chất khí kết hợp hay không. Hãy vẽ một đường cong biểu diễn một quá trình đẳng áp, tức là một quá trình trong đó áp suất chất khí không đổi, sử dụng các trục tọa độ V và T.
HS A: Hình như em nhớ quá trình này được biểu diễn bằng một đường thẳng.
GV: Tại sao lại nhớ? Hãy sử dụng phương trình (104). Trên cơ sở đó, hãy biểu diễn thể tích của một chất khí là một hàm của nhiệt độ của nó.
HS A: Từ phương trình (104) ta có

GV: Áp suất ở đây có phụ thuộc vào nhiệt độ hay không?
HS A: Trong trường hợp đã cho, nó không phụ thuộc bởi vì chúng ta đang xét một quá trình đẳng áp.
GV: Tốt. Bây giờ thì tích (m/μ)(R/p) trong phương trình (106) là một hằng số tỉ lệ. Do đó, ta thu được sự phụ thuộc tuyến tính của thể tích chất khí vào nhiệt độ của nó. Các thí sinh thường có thể biểu diễn các quá trình đẳng áp (p = const), đẳng nhiệt (T = const) và đẳng tích (V = const) trên đồ thị với các trục tọa độ p và V. Đồng thời, các em thường thấy khó miêu tả những quá trình này với những tập hợp khác của trục tọa độ, ví dụ như V và T, hay T và p. Ba quá trình này được biểu diễn trên Hình 73 với những tập hợp khác nhau của trục tọa độ.
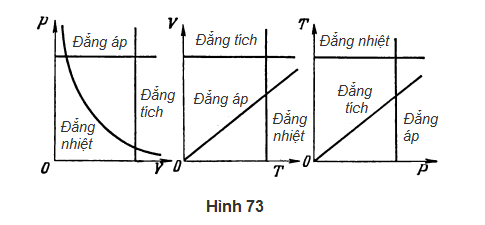
HS B: Em có một câu hỏi về đường đẳng áp trong đồ thị với trục tọa độ V và T. Từ phương trình (106) và từ đường cong tương ứng ở Hình 73, ta thấy khi nhiệt độ tiến tới không, thể tích của chất khí cũng tiến tới không. Tuy nhiên, không thể có chuyện thể tích của một chất khí có thể nhỏ hơn tổng thể tích của tất cả các phân tử của nó. Vậy lập luận của em sai ở chỗ nào?
GV: Các phương trình (102), (103), (104) và (106) áp dụng cho cái gọi là chất khí lí tưởng. Chất khí khí lưởng là một mô hình đã đơn giản hóa của một khí thực trong đó kích cỡ của các phân tử và lực hút tương hỗ của chúng đều không được xét đến. Tất cả các đường cong trên Hình 73 áp dụng cho một mô hình đã đơn giản hóa như thế, tức là áp dụng cho chất khí lí tưởng.
HS B: Nhưng các định luật chất khí khá khớp với số liệu thực nghiệm, và trong các thí nghiệm chúng ta xét chất khí thực có các phân tử có kích cỡ riêng của chúng.
GV: Cần lưu ý rằng những thí nghiệm như thế chưa từng được thực hiện ở những nhiệt độ cực thấp. Nếu một chất khí thực không bị quá lạnh hay quá nén, thì nó có thể được mô tả khá chính xác bằng mô hình khí lí tưởng. Cũng lưu ý rằng đối với những chất khí có trong không khí (ví dụ nitrogen và oxygen), những điều kiện này được thỏa mãn ở nhiệt độ phòng và áp suất thường.
HS B: Có phải ý thầy muốn nói nếu chúng ta vẽ đồ thị sự phụ thuộc của thể tích vào nhiệt độ trong một quá trình đẳng áp cho một chất khí thực, thì đường cong đó sẽ trùng với đường thẳng tương ứng trong Hình 73 ở những nhiệt độ đủ cao nhưng sẽ không trùng ở vùng nhiệt độ thấp?
GV: Chính xác. Ngoài ra, hãy nhớ rằng với sự giảm nhiệt độ đủ đáng kể thì một chất khí sẽ ngưng tụ thành chất lỏng.
HS B: Em biết. Thật ra thì đường cong của phương trình (106) trong Hình 73 đi qua gốc tọa độ, hay điểm không, không có ý nghĩa vật lí. Nhưng có lẽ chúng ta nên kết thúc đường cong trước khi nó đi tới điểm này chứ?
GV: Điều đó là không nhất thiết. Em chỉ đang vẽ đường cong cho mô hình của một chất khí. Mô hình này có thể áp dụng ở đâu lại là một câu hỏi khác.
Bây giờ tôi muốn đề xuất như sau. Hai đường đẳng áp trong Hình 74 vẽ theo trục tọa độ V và T: một đường tương ứng với áp suất p1 và đường kia tương ứng với áp suất p2. Hỏi áp suất nào cao hơn?
HS A: Có khả năng nhất là p2 cao hơn p1.
GV: Em trả lời mà không thèm suy nghĩ gì hết. Rõ ràng, em trả lời như thế vì đường đẳng áp đó dốc hơn, tương ứng với áp suất cao hơn. Tuy nhiên, câu trả lời này sai hoàn toàn. Tan của góc nghiêng của một đường đẳng áp bằng (m/μ)(R/p) theo phương trình (106). Suy ra áp suất càng cao thì góc nghiêng của đường đẳng áp càng nhỏ. Như vậy, trong trường hợp của chúng ta, p2 < p1. Ta có thể đi tới kết luận tương tự bằng cách lập luận khác. Ta hãy vẽ một đường đẳng nhiệt trong Hình 74 (xem đường đứt nét). Nó cắt đường đẳng áp p2 ở một giá trị thể tích chất khí cao hơn so với đường đẳng áp p1. Chúng ta biết rằng ở nhiệt độ không đổi, áp suất của chất khí sẽ càng cao khi thể tích của nó càng nhỏ. Kết luận này suy ra trực tiếp từ định luật chất khí kết hợp [xem phương trình (103) hoặc (104)]. Như vậy, p2 < p1.
HS A: À, giờ thì em chắc rằng mình đã hiểu.
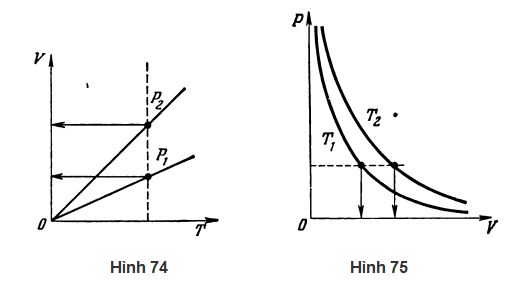
GV: Bây giờ nhìn vào Hình 75 cho thấy hai đường đẳng nhiệt (các trục tọa độ là p và V) được vẽ cho cùng một lượng khí ở những nhiệt độ khác nhau T1 và T2. Hỏi nhiệt độ nào cao hơn?
HS A: Trước tiên em sẽ vẽ một đường đẳng áp (xem đường đứt nét trong Hình 75). Ở một áp suất không đổi, nhiệt độ của một chất khí càng cao thì thể tích của nó càng lớn. Do đó, đường đẳng nhiệt phía ngoài, T2, tương ứng với nhiệt độ cao hơn.
GV: Chính xác. Hãy nhớ rằng: đường đẳng nhiệt càng gần gốc tọa độ của hệ trục p và V, thì nhiệt độ tương ứng càng thấp.
HS B: Ở trường THCS, chúng ta đã học các định luật chất khí trong phạm vi hẹp hơn nhiều so với cái được thảo luận ở đây. Định luật chất khí kết hợp chỉ vừa vặn được đề cập tới. Bài học của chúng ta hạn chế với định luật Boyle và Mariotte, định luật Gay-Lussac và định luật Charles.
GV: Ở phần này, tôi muốn đưa ra một số nhận xét sẽ cho phép các định luật Boyle và Mariotte, Gay-Lussac và Charles được gộp vào trong một khuôn khổ chung. Định luật Boyle và Mariotte (thường được gọi là định luật Boyle) mô tả sự phụ thuộc của p vào V trong một quá trình đẳng nhiệt. Phương trình cho định luật này có dạng
p = const / V (107)
trong đó const = (m/μ)RT.
Định luật Gay-Lussac mô tả sự phụ thuộc của p vào T trong một quá trình đẳng tích. Phương trình của nó là
p = const T (108)
trong đó const = (m/μ)(R/V).
Định luật Charles mô tả sự phụ thuộc của V vào T trong một quá trình đẳng áp. Phương trình của nó là
V = const T (109)
trong đó const = (m/μ)(R/p). [Phương trình (109) rõ ràng là lặp lại phương trình (106)] Tôi sẽ nêu ra những nhận xét sau đây về các định luật chất khí đã nói:
1. Toàn bộ những định luật này xét với chất khí lí tưởng và có thể áp dụng cho một chất khí thực chỉ trong trường hợp chất khí thực đó mô tả được bởi mô hình chất khí lí tưởng.
2. Mỗi định luật này xác lập một mối liên hệ giữa một cặp thông số nào đó của một chất khí với giả thuyết rằng thông số thứ ba là không đổi.
3. Như có thể dễ dàng thấy, mỗi định luật này là một hệ quả của định luật chất khí kết hợp [xem phương trình (104)] xác lập mối liên hệ giữa cả ba thông số bất kể những điều kiện đặc biệt này.
4. Các hằng số trong mỗi định luật này có thể được biểu diễn, không phải theo khối lượng của chất khí và thông số thứ ba không đổi, mà theo cùng cặp thông số đó xét cho một trạng thái khác của cùng lượng khí đó. Nói cách khác, các định luật chất khí có thể được viết lại ở dạng
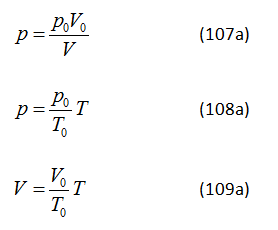
HS A: Hình như cuối cùng thì em đã hiểu cái cốt lõi của các định luật chất khí.
Những câu hỏi và bài tập vật lí phổ thông
L. Tarasov và A. Tarasova
Trần Nghiêm dịch
Phần tiếp theo >>