Chương 2
Tính chất của những chất tinh khiết
Trong chương này sẽ trình bày mối liên hệ giữa áp suất, thể tích riêng và nhiệt độ đối với một chất tinh khiết. Một chất tinh khiết là đồng nhất, nhưng có thể tồn tại ở nhiều hơn một pha, với mỗi pha có thành phần hóa học giống nhau. Nước là một chất tinh khiết; những kết hợp đa dạng của ba pha của nó (hơi, lỏng, băng) có thành phần hóa học giống nhau. Không khí ở pha khí là một chất tinh khiết, nhưng không khí lỏng có thành phần hóa học khác biệt. Không khí không phải là một chất tinh khiết nếu nó tồn tại ở nhiều hơn một pha. Ngoài ra, ta chỉ xét một chất đơn giản có thể nén được, một chất về cơ bản không có các hiệu ứng điện, từ và suất căng bề mặt.
2.1 Mặt P – υ – T
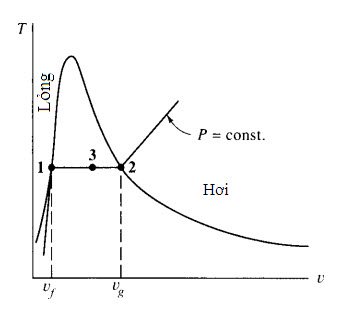
Người ta biết rõ rằng một chất có thể tồn tại ở ba pha khác nhau: rắn, lỏng và khí. Giả sử một chất rắn được chứa trong một hệ thống bình trụ-piston sao cho áp suất được duy trì ở một giá trị không đổi; nhiệt được đưa vào bình trụ, làm cho chất trải qua cả ba pha, như trên Hình 2.1. Chúng ta sẽ ghi lại nhiệt độ T và thể tích riêng u trong thí nghiệm trên. Bắt đầu với chất rắn ở một nhiệt độ thấp nào đó, như trên Hình 2.2a; sau đó bổ sung nhiệt cho đến khi nó hóa lỏng hoàn toàn (u không tăng bao nhiêu). Sau khi toàn bộ chất rắn đã tan chảy, nhiệt độ của chất lỏng tiếp tục được tăng lên cho đến khi hơi bắt đầu hình thành; trạng thái này được gọi là trạng thái chất lỏng bão hòa. Trong sự biến đổi pha từ lỏng sang hơi1, gọi là sự hóa hơi, nhiệt độ giữ nguyên không đổi trong khi nhiệt lượng được bổ sung vào. Cuối cùng, toàn bộ chất lỏng bay hơi hết và tồn tại trạng thái hơi bão hòa, sau đó nhiệt độ tăng lên theo nhiệt lượng bổ sung vào. Lưu ý, thể tích riêng của chất rắn và chất lỏng nhỏ hơn nhiều so với thể tích riêng của hơi ở những áp suất tương đối thấp.
1Sự biến đổi pha từ hơi sang lỏng gọi là sự ngưng tụ.
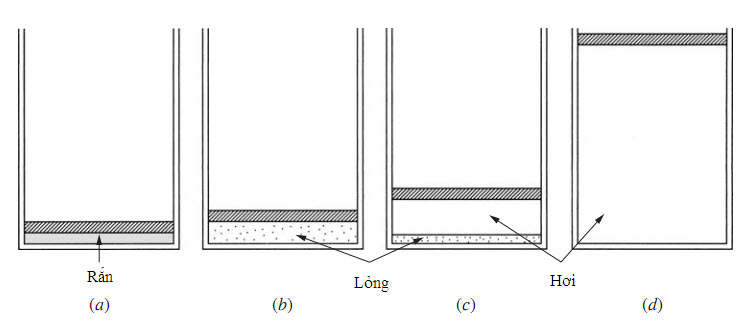
Hình 2.1 Các pha rắn, lỏng, hơi của một chất
Nếu lặp lại thí nghiệm một số lần ở những áp suất khác nhau, ta sẽ thu được một đồ thị T-u, thể hiện trên Hình 2.2b. Ở những áp suất vượt quá áp suất tới hạn, chất lỏng dễ dàng biến đổi thành hơi mà không cần một quá trình hóa hơi nhiệt độ không đổi. Các giá trị tính chất của điểm tới hạn đối với những chất khác nhau được cho trong Bảng B.3.
Thí nghiệm trên có thể thực hiện bằng cách giữ nhiệt độ cố định và giảm áp suất, như trên Hình 2.3a (chất rắn không được trình bày). Chất rắn sẽ biến đổi thành chất lỏng, và chất lỏng biến đổi thành hơi, như trong thí nghiệm đưa đến Hình 2.2. Đồ thị T-υ, chỉ trình bày pha rắn và hơi, thể hiện trên Hình 2.3b.
Quá trình nóng chảy, hóa hơi và thăng hoa (sự biến đổi của một chất rắn trực tiếp thành hơi) được thể hiện trên Hình 2.3c. Sự méo mó ở cả ba đồ thị là để cho những khác nhau đều được thể hiện. Điểm ba là điểm tại đó cả ba pha tồn tại ở trạng thái cân bằng với nhau. Một đường đẳng áp được thể hiện trên đồ thị T-υ và một đường đẳng nhiệt trên đồ thị P-υ; một trong hai đồ thị này thường được phác thảo trong những bài toán liên quan đến sự biến đổi pha từ lỏng sang hơi.
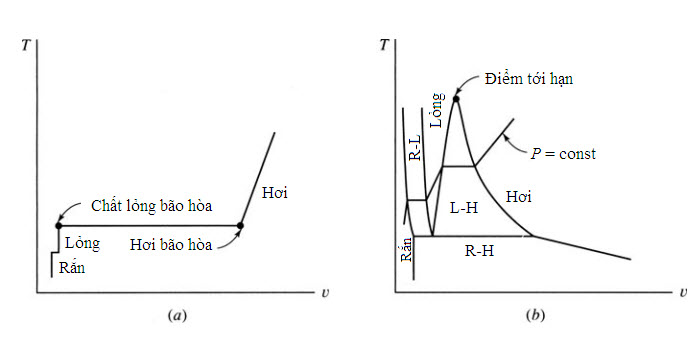
Hình 2.2 Đồ thị T-υ
Trên thực tế, ta thường quan tâm những tình huống liên quan đến vùng lỏng, lỏng-hơi, và hơi. Một chất hơi bão hòa nằm phía trên đường hơi bão hòa và một chất lỏng bão hòa nằm phía trên đường lỏng bão hòa. Vùng phía bên phải đường hơi bão hòa là vùng quá nhiệt; vùng phía bên trái đường lỏng bão hòa là vùng chất lỏng nén (còn gọi là vùng chất lỏng quá nguội). Trạng thái siêu tới hạn xảy ra khi áp suất và nhiệt độ lớn hơn các giá trị tới hạn.

Hình 2.3 Đồ thị (a) P-υ, (b) T-υ, và (c) P-T
Nhiệt động lực học căn bản
Merle C Potter
Bản dịch của Thuvienvatly.com