Bên trong hạt nhân
Rutherford và đội của ông tiếp tục nghiên cứu tán xạ hạt alpha của họ cho đến năm 1913, sử dụng các nguồn hạt alpha khác nhau và các lá kim loại khác nhau để tinh chỉnh những kết luận của họ. Khi đó, mô hình hạt nhân của nguyên tử đã được thiết lập vững chắc. Nhưng cái gì làm cho hạt nhân của một chất khác với hạt nhân của chất kia? Hai con số rõ ràng quan trọng là điện tích và khối lượng. Điện tích dương của hạt nhân tương ứng với nhân dạng của hạt nhân là một nguyên tố hóa học nhất định, hoặc chỗ nó nằm khớp trong bảng tuần hoàn. Khi bị bao quanh bởi một số electron bằng với điện tích đó, nó là một nguyên tử trung hòa, và các electron là nguyên nhân cho hành trạng hóa học của nguyên tử đó.
Khối lượng hạt nhân, như Soddy chỉ rõ, có thể khác nhau giữa hai đồng vị thuộc cùng một nguyên tố. Nhưng khối lượng, giống như điện tích, dường như xuất hiện theo đơn vị cơ bản. Hạt nhân đơn giản nhất là hydrogen, với một đơn vị điện tích và một đơn vị khối lượng.
Khi Thế chiến thứ nhất bùng nổ vào năm 1914, nghiên cứu vật lí cơ bản là một trong những lĩnh vực chịu tổn thất do sinh viên bị gọi nhập ngũ hoặc phục vụ cho những nhiệm vụ thời chiến khác. Bản thân Rutherford cũng trở nên dính líu với việc dò tìm tàu ngầm, nhưng ông còn có thời gian để tiếp tục nghiên cứu trong phòng thí nghiệm. Ông quyết định theo đuổi một kết quả gây tò mò của Marsden, người đã bắn phá chất khí hydrogen bằng các hạt alpha.
Khi một hạt alpha va chạm với một hạt nhân cố định, nặng hơn, thuộc một nguyên tố kim loại, nó đổi hướng chuyển động nhưng mất ít năng lượng. Tuy nhiên, khi bia là chất khí hydrogen, thì cú va chạm tương tự như quả bi-a bị bắn bởi quả cầu nặng khác. Cả hạt alpha và hạt nhân hydrogen đều nảy ngược trở lại khỏi chỗ va chạm. Nếu nó là một va chạm gần như trực diện, thì hạt nhân hydrogen có thể bật đi ở tốc độ còn cao hơn cả tốc độ mà hạt alpha tới có được.
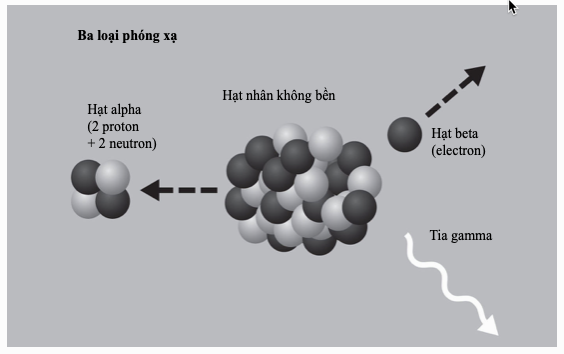
Lúc ấy, Rutherford bắt đầu gọi hạt nhân hydrogen là proton để ngụ ý rằng chúng là những hạt hạ nguyên tử cơ bản giống như electron. Hơn nữa, những thí nghiệm đó đã dạy ông cách phân biệt proton với các hạt alpha khi chúng đập lên màn hình dò tìm của ông. Khả năng ghi nhận proton sớm tỏ ra rất hữu ích. Khi Rutherford bắt đầu bắn phá chất khí nitrogen với các hạt alpha, ông phát hiện ra proton mặc dù ban đầu ông chẳng làm gì liên quan đến hydrogen. Kết luận của ông là va chạm đó đã làm cho hạt nhân nitrogen bị vỡ ra và giải phóng một proton. Kết luận đó nói chung là đúng, mặc dù các nhà khoa học không thể mô tả chính xác sự biến đổi hạt nhân mãi cho đến những năm 1920, ấy là như thế này: một hạt alpha (điện tích 2, khối lượng 4) kết hợp với một hạt nhân nitrogen (điện tích 7, khối lượng 14) tạo ra một proton (điện tích 1, khối lượng 1) và một đồng vị bền nhưng không phổ biến của oxygen (điện tích 8, khối lượng 17). Rutherford phát hiện ra proton chứ không phải hạt nhân oxygen.
Từ cái Rutherford quan sát thấy, dường như có thể nghĩ hợp lí là mọi hạt nhân được cấu thành từ các proton. Điều đó sẽ giải thích cho điện tích hạt nhân nhưng không giải thích được những khối lượng lớn hơn của chúng. Đồng thời cũng phát sinh câu hỏi cái gì đã giữ một hạt nhân lại với nhau. Hai hoặc nhiều proton trong một không gian hạn chế như vậy sẽ đẩy lẫn nhau với lực rất lớn. Một số nhà vật lí cho rằng hạt nhân có thể chứa một số nhất định những proton khác nữa và số lượng đó bằng số lượng electron, nhưng Rutherford không tán thành. Ông cho rằng một electron tích điện âm và một proton tích điện dương bên trong một hạt nhân sẽ hút lẫn nhau đủ mạnh nên chúng sẽ không thể chia tách, về cơ bản là hình thành nên một hạt trung hòa.
Năm 1920, ông đã lí thuyết hóa những “bộ đôi trung hòa” như thế là loại thứ ba thuộc những viên gạch cấu trúc nguyên tử cơ bản sau electron và proton. Ông gọi hạt được đề xuất này là neutron. Ông lưu ý rằng khối lượng của nó rất gần với khối lượng của proton. Như vậy, số nguyên tử của một đồng vị, cái xác định vị trí của nó trong bảng tuần hoàn, là số proton của nó, còn khối lượng nguyên tử của nó là tổng số proton và neutron của nó.
Đến tận năm 1932 thì neutron mới được phát hiện, và rất muộn sau này người ta mới hiểu loại lực đã liên kết hạt nhân lại với nhau, nhưng vào cuối thập niên thứ hai của thế kỉ 20, Rutherford đã mang lại sự mô tả chính xác thành phần cấu tạo của các nguyên tử: các electron bao xung quanh một hạt nhân nặng nhưng rất nhỏ gồm các proton và neutron.
Có lẽ ông đã dùng từ hơi khác, vì các nhà vật lí lúc ấy nói đến các electron quay trong quỹ đạo – chứ không đơn thuần là bao quanh hạt nhân của chúng. Tuy nhiên, những phát triển trong lí thuyết lượng tử thuộc thập niên 1920 sẽ đưa các nhà vật lí đến một quan điểm mới về các quỹ đạo electron và bản thân electron.
Lịch sử vật lí thế kỉ 20 - Alfred B. Bortz
Bản dịch của Thuvienvatly.com
<< Phần trước | Phần tiếp theo >>