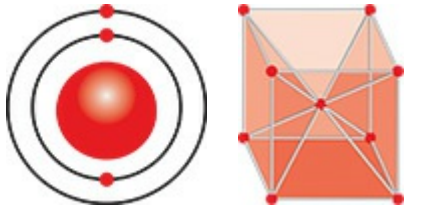
Mẫu nguyên tử Bohr
Sự tinh chỉnh đáng kể nhất đầu tiên của mô hình hạt nhân Rutherford xuất hiện vào năm 1913, khi nhà vật lí 28 tuổi, người Copenhagen, tên là Niels Bohr (1885–1962) công bố một loạt bài báo nhanh chóng thu hút sự quan tâm lớn. Mục đích chính của những bài báo này là đề xuất một khuôn khổ lí thuyết loại vấn đề bức xạ điện từ ra khỏi các electron đang quay tròn, nhưng tác động của chúng hóa ra còn rộng hơn thế nhiều. Chúng đã chuyển lượng tử của Planck từ chỗ hạn chế là tương tác của ánh sáng với vật chất sang lĩnh vực cấu trúc nguyên tử rộng hơn.
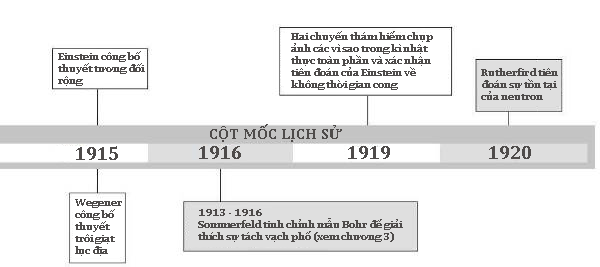
Planck đã phát hiện ra lượng tử trong khi phân tích quang phổ liên tục trong ánh sáng phát ra bởi các vật nóng như dây tóc của các bóng đèn nóng sáng. Bohr thì tập trung chú ý vào quang phổ vạch tạo ra khi dòng điện đi qua một chất khí áp suất thấp trong một ống trụ, tạo ra sự phát sáng, ví dụ như màu đỏ đặc trưng của bóng đèn neon. Tại sao các chất khí bị kích thích điện phát ra những lượng tử chỉ thuộc những tần số nhất định? Đâu là cơ sở của những mẫu hình toán học ở những tần số đó, ví dụ như dãy vạch phổ phát ra từ hydrogen đã được nhận ra trước đấy 30 năm bởi một giáo viên trung học người Thụy Sĩ, Johann Balmer (1825–98)?

Niels Bohr đã phát triển một lí thuyết giải thích quang phổ vạch của hydrogen là kết quả của các electron thực hiện các chuyển tiếp giữa những mức năng lượng được phép và phát ra những lượng tử ánh sáng có năng lượng bằng với sự chênh lệch giữa các mức.
Bohr bắt đầu phân tích của ông bằng cách giả sử rằng quang phổ vạch là kết quả của sự phát xạ từ những nguyên tử cá lẻ. Các mẫu tần số có mặt trong những phát xạ đó có thể làm sáng tỏ vì sao các quỹ đạo electron là bền trong sự vi phạm hiển nhiên của các định luật điện từ học hay không ? Điều gì sẽ xảy ra nếu các định luật vật lí chỉ đòi hỏi những quỹ đạo nhất định là bền? Với một electron đơn độc, hydrogen là nguyên tử đặc biệt dễ phân tích. Công thức cho lực hút hấp dẫn và lực hút điện có cùng dạng thức toán học với điện tích thay thế cho khối lượng và một hằng số điện thay thế cho hằng số hấp dẫn. Cả hai phát biểu rằng lực giảm khi khoảng cách tăng lên theo mối quan hệ tỉ lệ nghịch bình phương. Nếu khoảng cách tăng gấp đôi, thì lực giảm bằng một phần tư (một phần hai nhân hai) giá trị trước đó của nó; nếu khoảng cách tăng ba lần, thì lực giảm đi chín lần (ba lần ba); và cứ thế.
Các phép toán về cơ bản là giống như trường hợp quỹ đạo của một hành tinh (electron) quay xung quanh Mặt trời (hạt nhân hydrogen) mà không có sự tác động phức tạp của những vật thể khác. Các định luật của chuyển động và điện từ học tiên đoán một quan hệ toán học đơn giản giữa kích cỡ quỹ đạo của electron và thời gian cần thiết để nó quay trọn một vòng. Mối quan hệ đó tương tự như định luật thứ hai trong số ba định luật chuyển động hành tinh của nhà thiên văn học thế kỉ 17 Johannes Kepler (1571–1630). Định luật đó là một phương trình liên hệ khoảng cách của hành tinh đến Mặt trời và độ dài năm của nó.
Mẫu nguyên tử Bohr cũng có những tương đương với các định luật thứ nhất và thứ ba, nhưng Bohr đưa thêm vào một thứ mà Kepler không cần đến: một quy luật cấm những chu kì quỹ đạo được phép. Bohr phát biểu rằng các quỹ đạo electron chỉ là bền nếu năng lượng của chúng bằng với một số nguyên lần tích của hằng số Planck và tần số quỹ đạo. Nó giống hệ như hệ mặt trời cấm những quỹ đạo hành tinh sao cho không có vật thể nào trong quỹ đạo xung quanh Mặt trời có chu kì 365 hoặc 366 ngày, mà chỉ có chính xác chiều dài năm của Trái đất (365,24 ngày).
Trong mẫu Bohr, các electron thực hiện những chuyển tiếp giữa các mức năng lượng cho phép bằng cách phát xạ hoặc hấp thụ một lượng tử ánh sáng có năng lượng bằng với sự chênh lệch giữa các mức. Do đó, mẫu Bohr có thể tính ra một tập hợp những tần số được phép của ánh sáng phát xạ. Điều đáng chú ý là chúng phù hợp chính xác với quang phổ hydrogen. Lí thuyết Bohr còn thành công, nhưng không rực rỡ lắm, trong việc tiên đoán quang phổ vạch của những nguyên tử phức tạp hơn, giống hệt như các định luật Kepler không có giá trị chính xác khi xét đến tác động của những hành tinh khác nữa. Tuy nhiên, những thành công của lí thuyết ấy cho thấy các định luật của điện từ học không áp dụng được cho các electron trong nguyên tử, chừng nào quỹ đạo của chúng phù hợp với những điều kiện đặc biệt. Các nhà vật lí không hoàn toàn hài lòng với điều đó, nhưng rõ ràng, phân tích của Bohr, giống như phân tích của Planck trước đó, đang cho họ biết cái gì đó cơ bản về thế giới nguyên tử.
Lịch sử vật lí thế kỉ 20 - Alfred B. Bortz
Bản dịch của Thuvienvatly.com
<< Phần trước | Phần tiếp theo >>