MẪU NGUYÊN TỬ BOHR
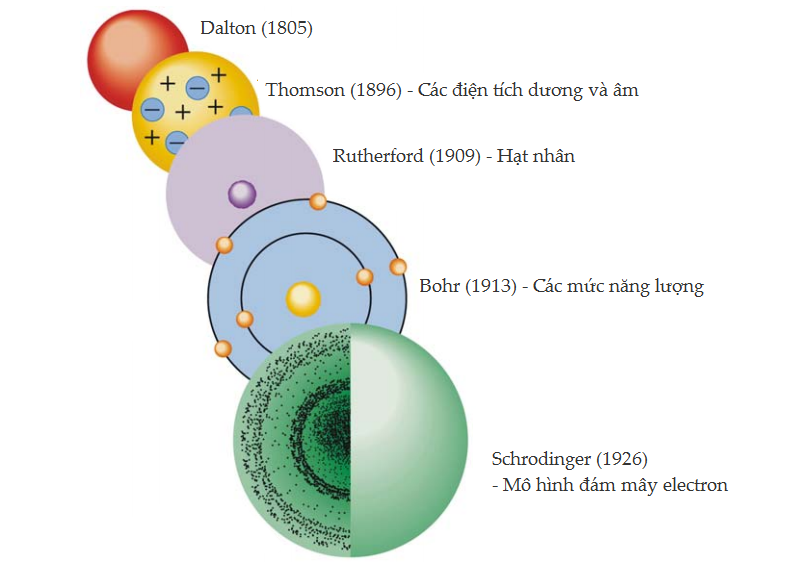
Mô hình hạt nhân của Rutherford phát biểu đơn giản rằng nguyên tử có một hạt nhân và các electron tích điện âm có mặt bên ngoài hạt nhân. Nó chẳng nói điều thêm điều gì, ví dụ như các electron đó được sắp xếp như thế nào và ở đâu. Nó cũng không thể giải thích tại sao các electron lại không rơi vào trong hạt nhân do lực hút tĩnh điện. Vào năm 1913, Niels Bohr đề xuất một mô hình mới của nguyên tử giải thích được một số đặc điểm này, đồng thời giải thích quang phổ phát xạ của hydrogen. Lí thuyết Bohr được xây dựng trên thuyết lượng tử Planck và được xây dựng trên các tiên đề sau đây.
Các tiên đề của lí thuyết Bohr
(1) Các electron chuyển động xung quanh hạt nhân trong những quỹ đạo tròn được phép nhất định và không có những quỹ đạo nào khác.
Các electron trong mỗi quỹ đạo có một năng lượng xác định và cách hạt nhân một khoảng cố định. Các quỹ đạo được gán kí hiệu n và từng quỹ đạo được đánh số 1, 2, 3,... (hoặc K, L, M,...) theo thứ tự khoảng cách đến hạt nhân tăng dần.
(2) Trong lúc chuyển động trong những quỹ đạo riêng này, electron không phát xạ (hay thất thoát) năng lượng.
Do đó, trong mỗi quỹ đạo này, năng lượng của mỗi electron vẫn giữ nguyên, tức là không tăng thêm cũng không giảm. Vì thế, các quỹ đạo riêng có sẵn cho electron trong một nguyên tử được gọi là các mức năng lượng dừng, hay gọi đơn giản là các mức năng lượng.
(3) Electron có thể chuyển từ mức năng lượng này sang mức năng lượng khác chỉ bằng các bước nhảy lượng tử, hay các bước nhảy photon.
Khi electron ở trong quỹ đạo có năng lượng thấp nhất (đó cũng là mức gần hạt nhân nhất), electron được gọi là ở trạng thái cơ bản. Khi electron được cấp năng lượng, nó hấp thụ một lượng tử hay một photon năng lượng và nhảy lên một mức năng lượng cao hơn. Khi đó, electron có thế năng và nó được gọi là ở trạng thái kích thích.
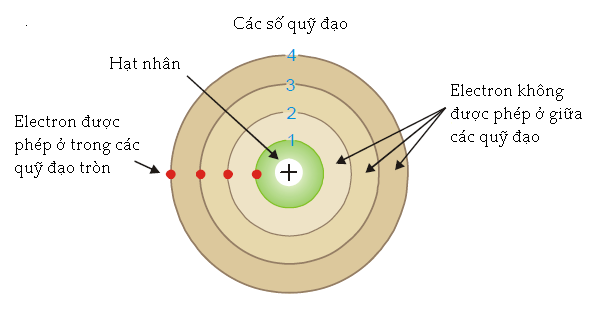
Hình 1.25
Các quỹ đạo tròn của electron hay các mức năng lượng dừng trong một nguyên tử.
Lượng tử hay photon năng lượng được phát xạ hay hấp thụ bằng độ chênh lệch giữa các mức năng lượng thấp và cao của nguyên tử
ΔE = Ecao - Ethấp = hν (1)
trong đó h là hằng số Planck và ν là tần số của photon năng lượng được phát ra hay hấp thụ.
(4) Moment động lượng (mvr) của mỗi electron đang quay xung quanh hạt nhân bằng một bội số nguyên của hằng số Planck chia cho 2p.
Moment động lượng = mvr = n(h/2π) (2)
trong đó m = khối lượng electron, v = vận tốc của electron, r = bán kính quỹ đạo; n = 1, 2, 3,... và h = hằng số Planck.
Bằng cách thay các giá trị 1, 2, 3 cho n, ta lần lượt thu được các giá trị moment động lượng
h/2π, 2h/2π, 3h/2π,...
Không có các giá trị phân số của h/2p. Vì thế, người ta nói moment động lượng bị lượng tử hóa. Số nguyên n trong phương trình (2) có thể được dùng để kí hiệu cho một quỹ đạo và một mức năng lượng tương ứng n được gọi là số lượng tử chính của nguyên tử.
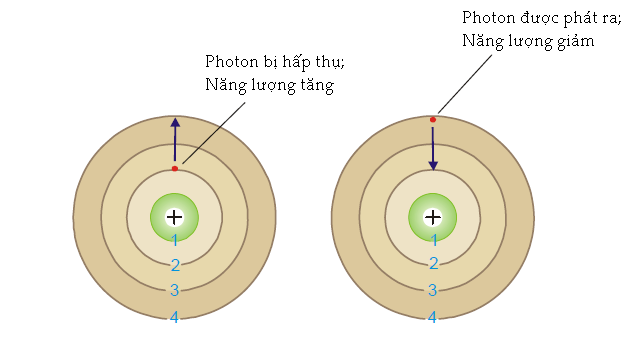
Hình 1.26
Electron hấp thụ một photon ánh sáng khi nó nhảy từ một quỹ đạo năng lượng thấp lên quỹ đạo năng lượng cao hơn và một photon được phát ra khi electron nhảy trở lại mức năng lượng thấp ban đầu.
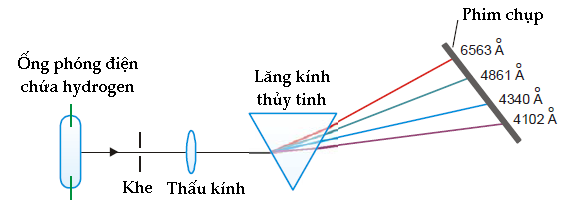
Sử dụng các tiên đề trên và một số định luật vật lí cổ điển, Bohr có thể tính ra bán kính của từng quỹ đạo của nguyên tử hydrogen, năng lượng gắn liền với mỗi quỹ đạo và bước sóng của bức xạ phát ra trong các chuyển tiếp giữa các quỹ đạo. Các bước sóng tính được theo phương pháp này ăn khớp một cách tuyệt vời với các bước sóng trong quang phổ thực tế của hydrogen, đó là một thành công lớn cho mẫu nguyên tử Bohr.
Hóa Lí Căn Bản - Arun Bahl, B.S. Bahl, G.D. Tuli
Phần tiếp theo >>