Câu hỏi
🗣️ Nguyễn Thị Lộc hỏi: Cho mình hỏi một câu Đánh giá năng lực trong sách bài tập
- Anot của thiết bị là nơi xảy ra bán phản ứng oxi hóa. Anot được nối với cực dương của nguồn điện một chiều.
+ Gốc axit có chứa oxi không bị điện phân (ví dụ: NO3-, SO42-, PO43-, CO32-, ClO4-, …). Khi đó nước bị điện phân theo bán phản ứng: 2H2O → O2 + 4H+ + 4e
+ Thứ tự anion bị điện phân: S2- >I- >Br- >Cl- >RCOO- >OH- >H2O
- Catot của thiết bị là nơi xảy ra bán phản ứng khử. Catot được nối với cực âm của nguồn điện một chiều.
+ Nếu dung dịch có chứa nhiều cation thì cation nào có tính oxi hóa mạnh hơn sẽ bị điện phân trước.
+ Một số cation không bị điện phân như K+,Na+, Ca2+, Ba2+, Mg2+, Al3+… Khi đó nước bị điện phân theo bán phản ứng: 2H2O + 2e → H2 + 2OH-
Cho dãy điện hóa sau:
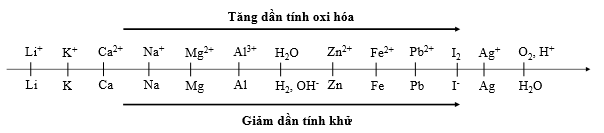
Thí nghiệm 1: Một sinh viên thực hiện quá trình điện phân dung dịch chứa đồng thời AgNO3, Cu(NO3)2, Fe(NO3)3, Mg(NO3)2 bằng hệ điện phân sử dụng các điện cực than chì.
Thí nghiệm 2: Sinh viên đó tiếp tục điện phân dung dịch X gồm 0,04 mol AgNO3 và 0,06 mol Fe(NO3)3 với I = 5,36A, điện cực trơ. Sau thời gian t giây, sinh viên đó lấy catot rửa sạch và sấy khô thấy catot tăng 5,44 gam.
(Cho NTK: Fe = 56 đvC; Ag = 108 đvC).
Trong Thí nghiệm 2, giá trị của t là
(A) 1800
(B) 1440,5.
(C) 2520,5.
(D) 1440
👩 Đánh giá của giáo viên: Câu này dễ, mức độ biết.
🔑 Chủ đề: bai tap ve su dien phan.
Câu trả lời hay nhất
🕵 Bạn Đinh Khanh Thành trả lời:
Chọn câu (C): 2520,5.
Trả lời: Ta thấy: \[{n_{Ag\,\max }} = {n_{AgN{O_3}}} = 0,04\left( {mol} \right)\] \[ \to {m_{Ag\,\max }} = 0,04.108\] =4,32(g)<5,44(g) ⟹ có Fe bám vào catot ⟹ Ag+ và Fe3+ đã bị điện phân hết, Fe2+ bị điện phân một phần. Khối lượng Fe bám vào catot là: \[{m_{Fe}} = 5,44 - 4,32 = 1,12\left( g \right)\] \[ \to {n_{Fe}}\frac{{1,12}}{{56}} = 0,02\left( {mol} \right)\] Tại catot (-): Ag+ + 1e → Ag 0,04 → 0,04 → 0,04 (mol) Fe3+ + 1e → Fe2+ 0,06 → 0,06 → 0,06 (mol) Fe2+ + 2e → Fe 0,04 ← 0,02 (mol) → Số mol e trao đổi là: ne = 0,04 + 0,06 + 0,04 = 0,14 mol → Thời gian điện phân là: \[t = \frac{{n{}_e.F}}{I} = \frac{{0,14.96500}}{{5,36}} = 2520,5\left( s \right)\]
Câu trước | Câu kế tiếp
Các câu trả lời
👤 Trần Thị Tài viết:
Chọn C, 2520,5.
➥ 🗣️ Nguyễn Thị Lộc trả lời: Cảm ơn bạn, câu này hình như có trong file doc này Đánh Giá Năng Lực - Bài tập về sự điện phân
👤 Lê Thị Phong viết:
Chọn D, 1440
👤 Trần Văn An viết:
Chọn B, 1440,5.
👤 Phạm Thị Nguyên viết:
Chọn A, 1800
👤 Phạm Văn Dũng viết:
Chọn C: 2520,5.
Gửi bạn các file hữu ích đi kèm câu hỏi:
- Đánh Giá Năng Lực - Bài tập về sự điện phân (.doc)
- PHÂN LOẠI VÀ PHƯƠNG PHÁP GIẢI MỘT SỐ BÀI TẬP VỀ VA CHẠM SỬ DỤNG ĐỊNH LUẬT BẢO TOÀN ĐỘNG LƯỢNG (.rtf)
- Bài tập về biểu thức u và i trong mạch điện xoay chiều (.docx)
- Đánh Giá Năng Lực - Bài tập Bài 20. Một số ví dụ về cách giải các bài toán thuộc phần động lực học có đáp án (.doc)
- Bài tập điện xoay chiều sử dụng giản đồ véc tơ (.docx)
- Bài tập về Sự chuyển hóa Năng lượng Trong dao động Điều hòa - Vật lý 11 - Kết nối tri thức và cuộc sống (.pdf)
- Quá trình điện là giai đoạn đầu của sự nhìn
- Tính chất điện của dây nano là do các electron quyết định



