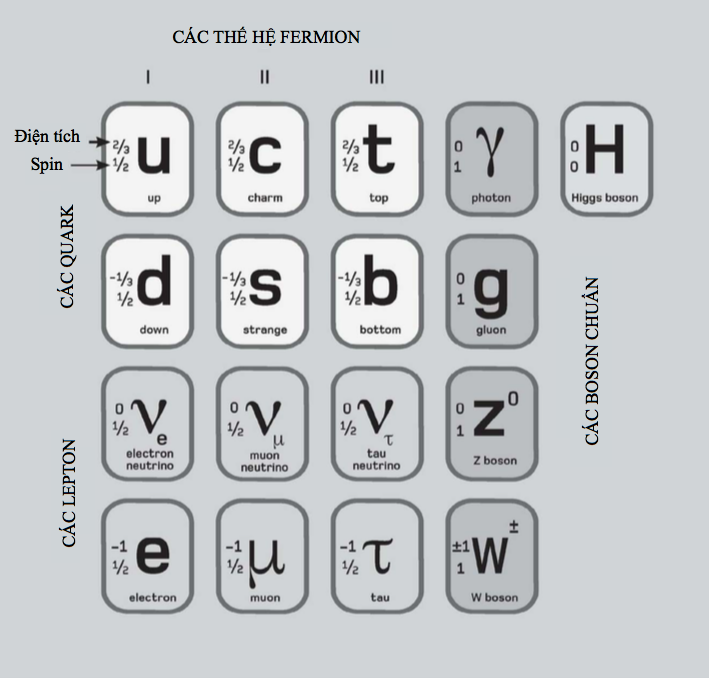
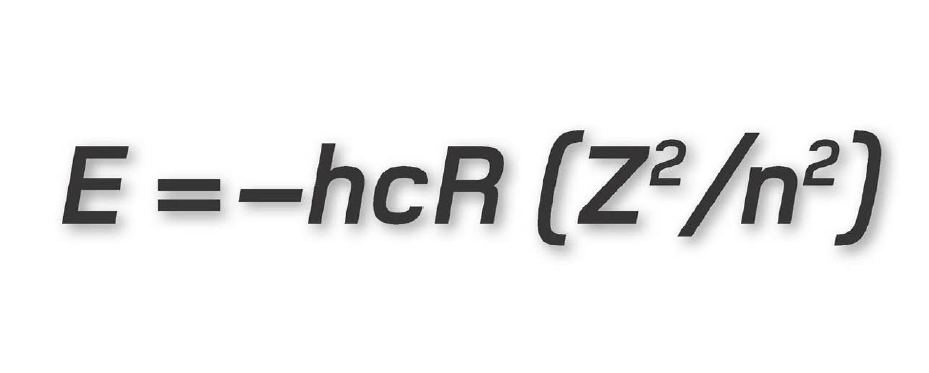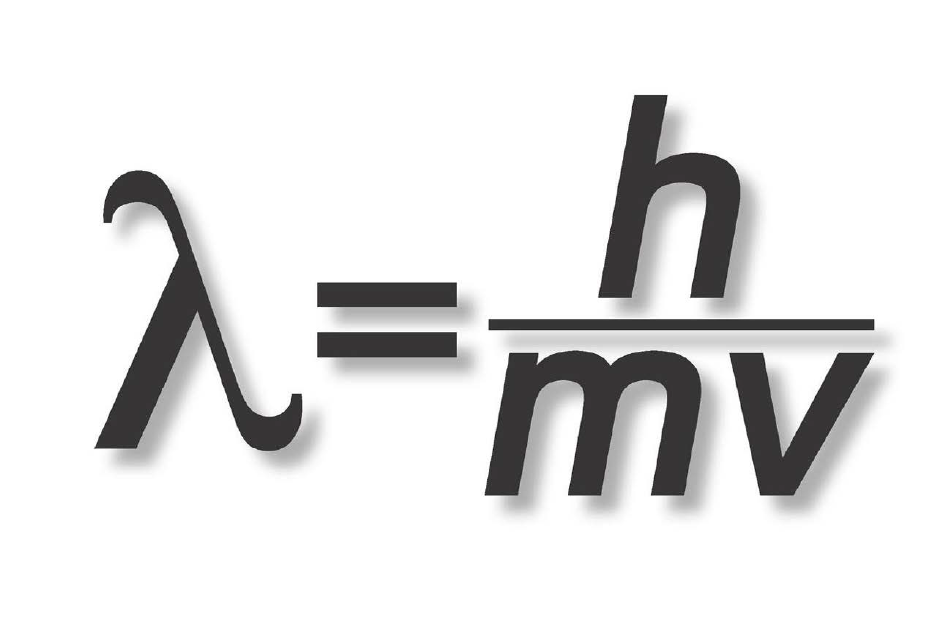Các số lượng tử
Số lượng tử chính mô tả mức năng lượng của các lớp vỏ electron không phải là cách duy nhất để chúng ta xác định một trạng thái lượng tử nào đó – tức là hàm sóng xác suất – của electron. Ngoài nó ra, còn có những số lượng tử quan trọng khác giúp xác định đặc tính của một electron.
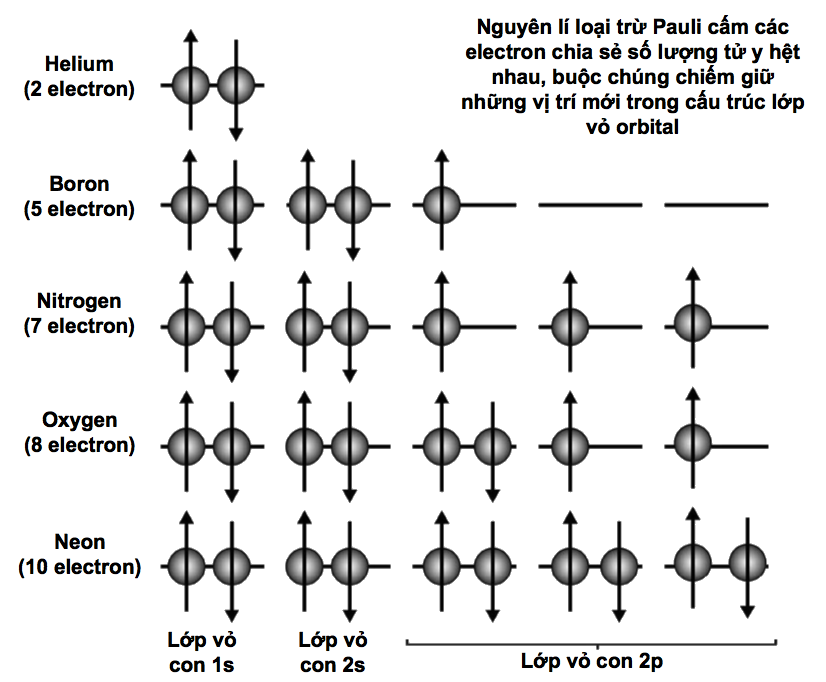
Các electron có một tính chất gọi là spin (s), nó có thể có số lượng tử ½ hoặc – ½. Đồng thời còn có số lượng tử ’phương vị’ (l) mô tả moment động lượng của electron (mặc dù khối lượng của mỗi hạt electron là rất nhỏ, cỡ 9,1.10-31 kg, nhưng nó có khối lượng, và do đó mỗi electron đang quay tròn phải có moment động lượng).
Cuối cùng, số lượng tử ‘từ’ (ml) mô tả các mức năng lượng có mặt trong các ‘lớp vỏ con’ của một lớp vỏ electron cho trước nào đó. Bên trong từ trường, ml còn có thể tạo ra những dịch chuyển khác ở năng lượng electron, liên quan đến một hiện tượng gọi là hiệu ứng Zeeman.
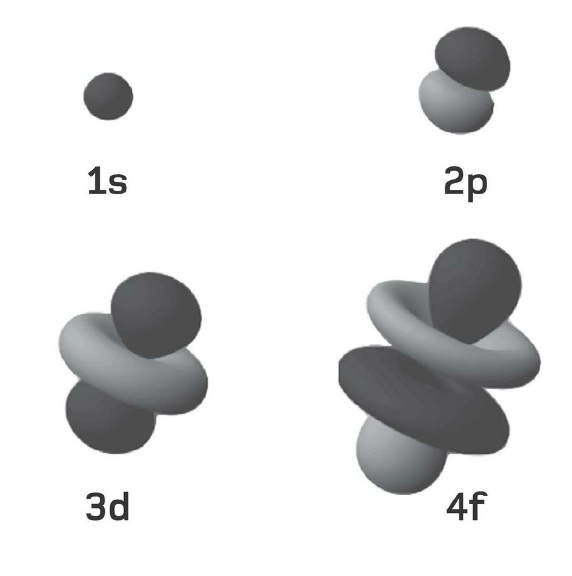
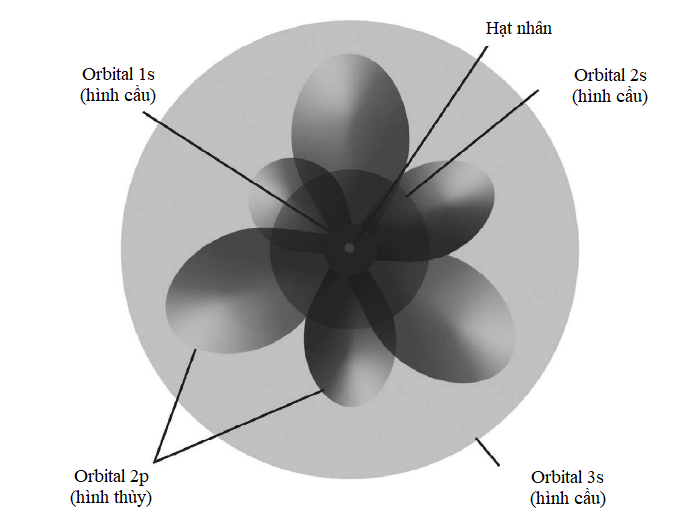
Số lượng tử và các orbital nguyên tử
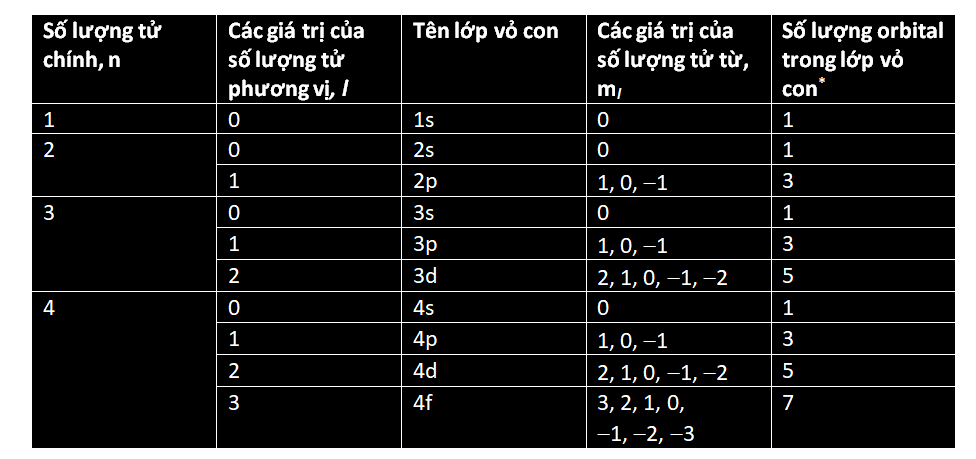
* Hai electron có thể cùng tồn tại trong một orbital nếu chúng có spin ngược nhau.
Các mức năng lượng electron
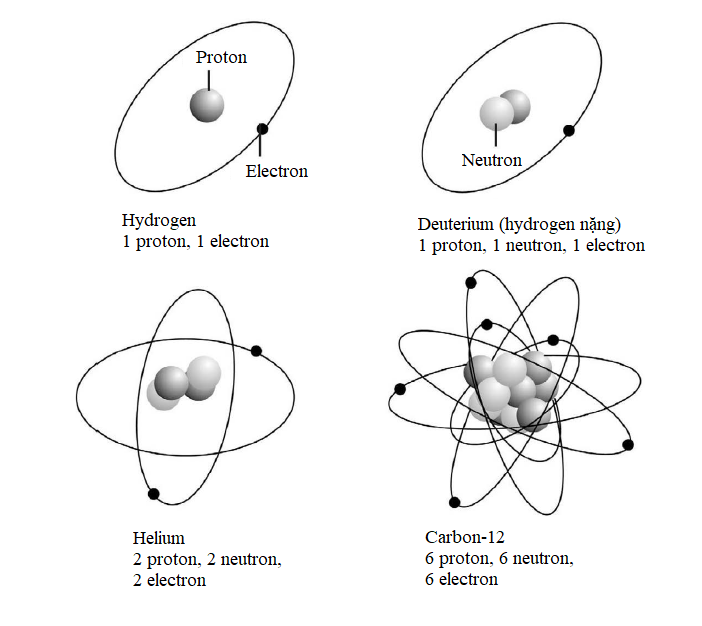
Mỗi lớp vỏ electron trong nguyên tử tồn tại ở một mức năng lượng, và electron chuyển động càng xa hạt nhân thì năng lượng mà nó phải có càng lớn. Ngược lại, electron cư trú càng gần hạt nhân, thì năng lượng mà nó cần càng ít.
Ví dụ, xét một nguyên tử argon. Nguyên tử này có 18 electron, vì vậy hoàn toàn lấp đầy các lớp vỏ K, L và M của nó. Các electron trong lớp vỏ K có năng lượng -4408 eV (electron-volt). Dấu trừ được giải thích bởi thực tế thế năng của electron chỉ đạt tới zero khi nó ở cách hạt nhân một khoảng vô hạn, vì thế tất cả các lớp vỏ electron ở gần hạt nhân đều được xét với năng lượng âm. Các electron trong lớp vỏ L có năng lượng -1102 eV và trong lớp vỏ M năng lượng của chúng là -489,78 eV, vì thế khoảng cách đến hạt nhân càng lớn thì mức năng lượng càng cao (càng tiến sát đến zero). Để cho một electron nhảy lên một lớp vỏ cao hơn, nó phải thu năng lượng bằng cách hấp thụ một photon. Ngược lại, khi nhảy xuống từ trạng thái kích thích này, nó phải mất một phần năng lượng bằng cách phát xạ một photon.
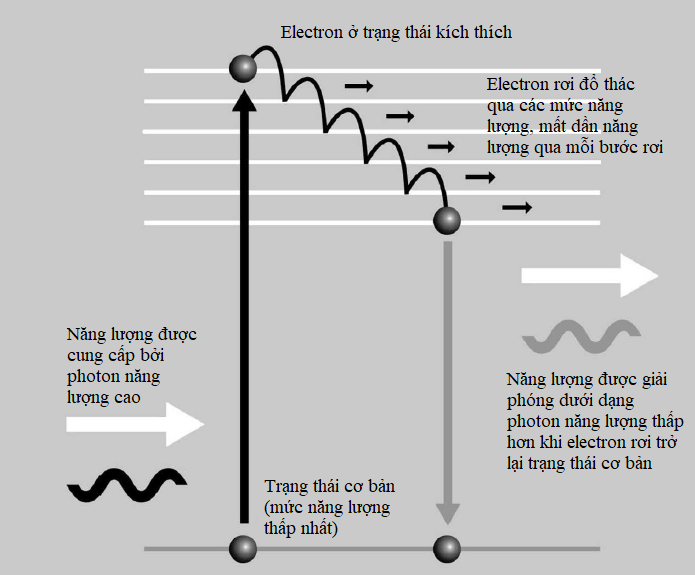
Vật liệu huỳnh quang phát sáng khi các electron bị kích thích bởi bức xạ năng lượng cao rơi trở lại trạng thái ban đầu của chúng và phát xạ lại những photon có năng lượng thấp hơn.
Vật lí Lượng tử Tốc hành | Gemma Lavender
Phần tiếp theo >>
Các số lượng tử
Số lượng tử chính mô tả mức năng lượng của các lớp vỏ electron không phải là cách duy nhất để chúng ta xác định một trạng thái lượng tử nào đó – tức là hàm sóng xác suất – của electron. Ngoài nó ra, còn có những số lượng tử quan trọng khác giúp xác định đặc tính của một electron.
Các electron có một tính chất gọi là spin (s), nó có thể có số lượng tử ½ hoặc – ½. Đồng thời còn có số lượng tử ’phương vị’ (l) mô tả moment động lượng của electron (mặc dù khối lượng của mỗi hạt electron là rất nhỏ, cỡ 9,1.10-31 kg, nhưng nó có khối lượng, và do đó mỗi electron đang quay tròn phải có moment động lượng).
Cuối cùng, số lượng tử ‘từ’ (ml) mô tả các mức năng lượng có mặt trong các ‘lớp vỏ con’ của một lớp vỏ electron cho trước nào đó. Bên trong từ trường, ml còn có thể tạo ra những dịch chuyển khác ở năng lượng electron, liên quan đến một hiện tượng gọi là hiệu ứng Zeeman.
Số lượng tử và các orbital nguyên tử
h
* Hai electron có thể cùng tồn tại trong một orbital nếu chúng có spin ngược nhau.
Các mức năng lượng electron
Mỗi lớp vỏ electron trong nguyên tử tồn tại ở một mức năng lượng, và electron chuyển động càng xa hạt nhân thì năng lượng mà nó phải có càng lớn. Ngược lại, electron cư trú càng gần hạt nhân, thì năng lượng mà nó cần càng ít.
Ví dụ, xét một nguyên tử argon. Nguyên tử này có 18 electron, vì vậy hoàn toàn lấp đầy các lớp vỏ K, L và M của nó. Các electron trong lớp vỏ K có năng lượng -4408 eV (electron-volt). Dấu trừ được giải thích bởi thực tế thế năng của electron chỉ đạt tới zero khi nó ở cách hạt nhân một khoảng vô hạn, vì thế tất cả các lớp vỏ electron ở gần hạt nhân đều được xét với năng lượng âm. Các electron trong lớp vỏ L có năng lượng -1102 eV và trong lớp vỏ M năng lượng của chúng là -489,78 eV, vì thế khoảng cách đến hạt nhân càng lớn thì mức năng lượng càng cao (càng tiến sát đến zero). Để cho một electron nhảy lên một lớp vỏ cao hơn, nó phải thu năng lượng bằng cách hấp thụ một photon. Ngược lại, khi nhảy xuống từ trạng thái kích thích này, nó phải mất một phần năng lượng bằng cách phát xạ một photon.
h