Cấu trúc nguyên tử
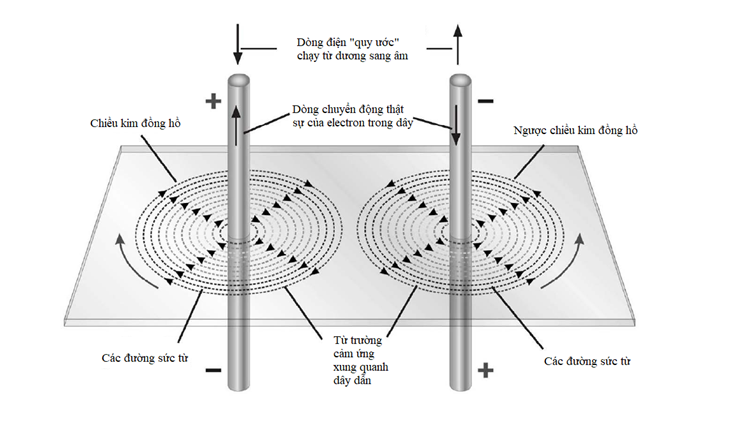
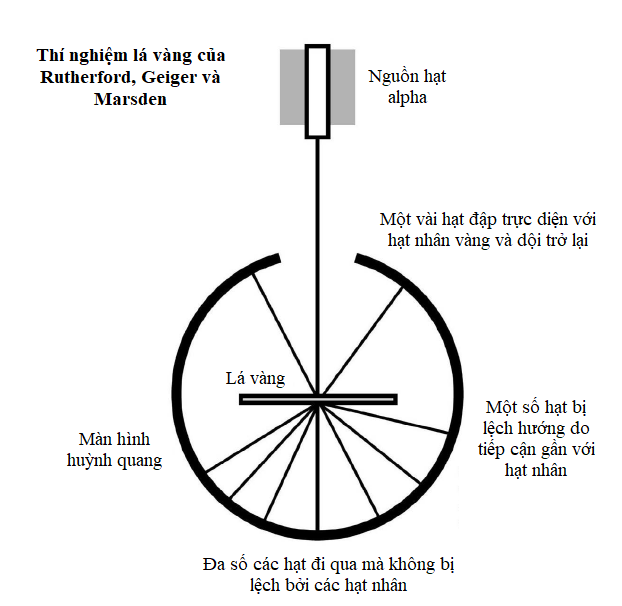
Mô hình nguyên tử mà Bohr và Rutherford mô tả là khá đơn giản, với một hạt nhân nguyên tử tại trung tâm, quay xung quanh là các electron trong quỹ đạo của chúng.
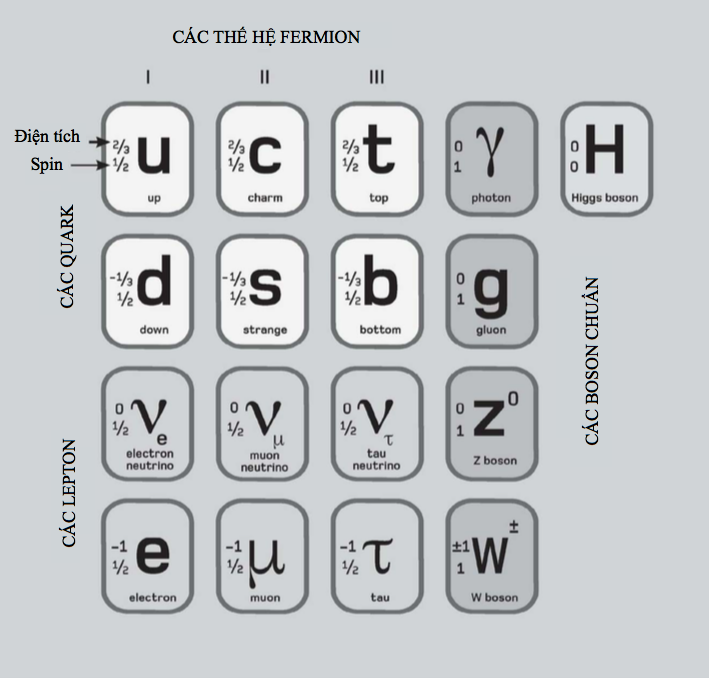
Hạt nhân là trung tâm của nguyên tử. Nó chứa phần lớn khối lượng của nguyên tử, và nó được làm bằng một hoặc nhiều ‘nucleon’, tên gọi ám chỉ proton hoặc neutron. Cả hai loại hạt này đều được cấu tạo bởi ba hạt nhỏ hơn gọi là quark. Proton mang điện tích dương, còn neutron trung hòa điện. Do bên trong một nguyên tử trung hòa điện tích là cân bằng, nên điện tích dương trên mỗi proton được triệt tiêu bởi điện tích âm của mỗi electron quay xung quanh nó.
Nguyên tố đơn giản nhất – hydrogen – thường có các nguyên tử bao gồm một proton độc thân cùng với một electron độc thân quay xung quanh. Hellium gồm hai proton và thường có hai neutron cùng với hai electron quay xung quanh. Ở đầu kia của bảng tuần hoàn, nguyên tố nặng nhất được biết có 118 proton, 118 electron và 176 neutron.
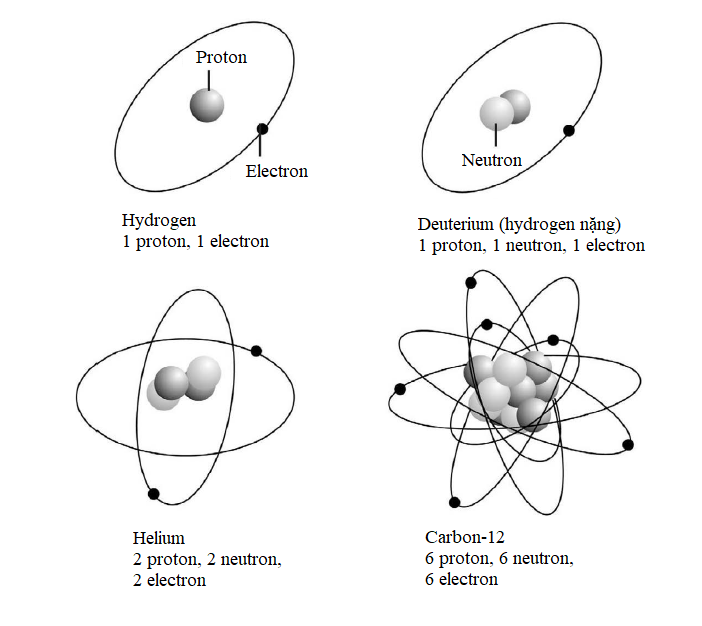
Những cấu trúc nguyên tử đơn giản
Lớp vỏ electron
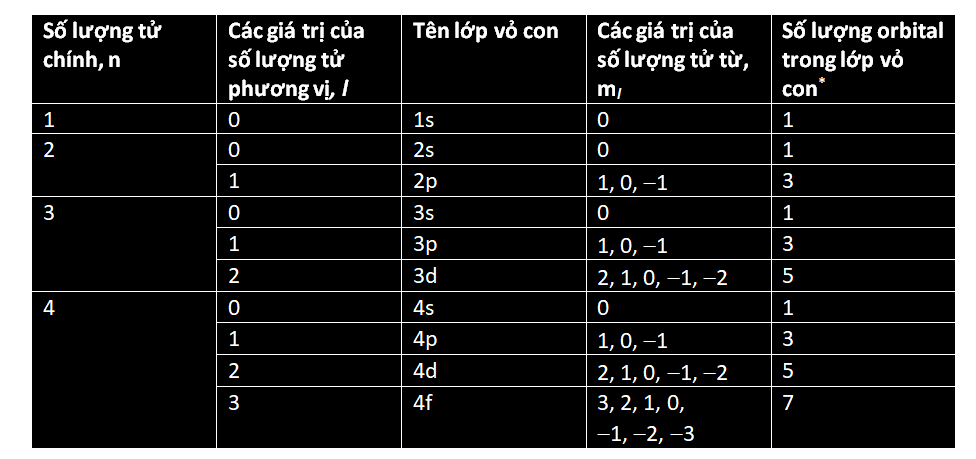
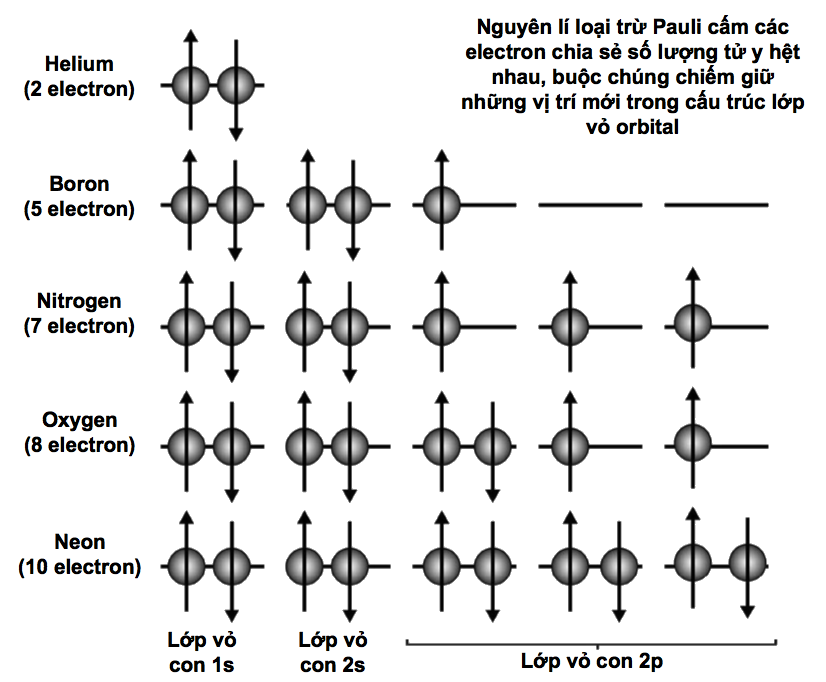
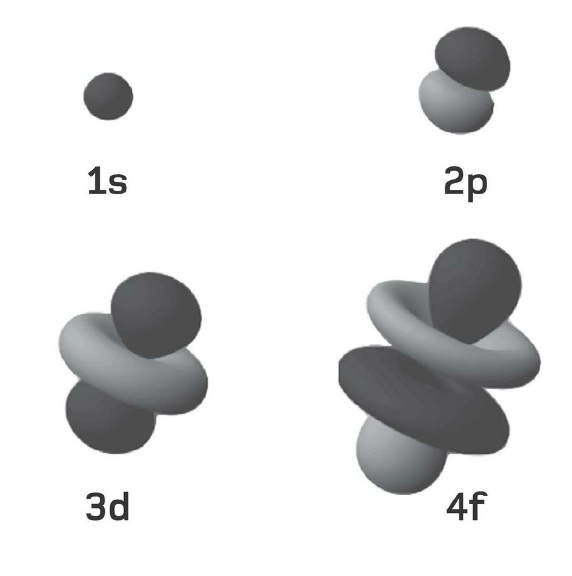
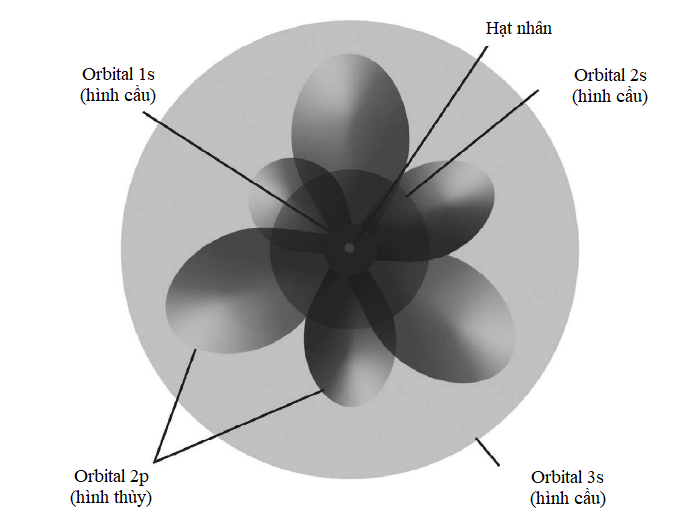
Các electron cư trú xung quanh hạt nhân nguyên tử trong những ‘lớp vỏ’ dùng chung. Một lớp vỏ càng ở xa hạt nhân thì số lượng electron mà nó có thể chứa càng nhiều. Lớp vỏ thứ nhất gọi là ‘lớp vỏ K’ và nó không chứa quá hai electron. Lớp vỏ thứ hai, gọi là ‘lớp vỏ L’, có thể chứa 8 electron; ‘lớp vỏ M’ thứ ba chứa tới 18 electron; ‘lớp vỏ N’ thứ tư chứa 32 electron; và cứ thế. Một công thức đơn giản cho phép bạn tính ra tổng số electron mà một nguyên tử có thể chứa trong một lớp vỏ cho trước: 2(n2), trong đó n số thứ tự của lớp vỏ, còn được gọi là ‘số lượng tử chính’. Như vậy, tính tổng cộng đến lớp vỏ M thì nguyên tử có thể chứa 2 ´ (12 + 22 + 32) = 2 ´ (1 + 4 + 9) = 28 electron.
Khối lượng nguyên tử càng lớn, thì số lượng electron mà có nó càng nhiều, vì thế càng có nhiều lớp vỏ. Trong mọi nguyên tử, lớp vỏ ngoài cùng được gọi là ‘lớp hóa trị’. Vì nó tương tác trực tiếp với các nguyên tử khác, nên lớp vỏ này giúp xác định tính chất hóa học của nguyên tử.
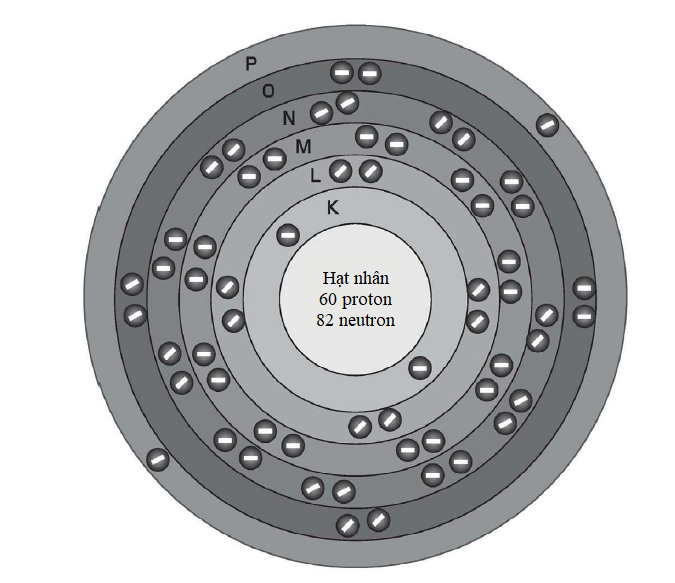
Hình minh họa sự phân bố electron trong nguyên tử neodymium (số nguyên tử 60). Sự phức tạp của các mức năng lượng electron nằm ở chỗ 32 electron ngoài cùng của nó được phân bố qua các lớp vỏ N, O và P, chứ không tập trung hết ở lớp vỏ N.
Vật lí Lượng tử Tốc hành | Gemma Lavender
Phần tiếp theo >>