Thuyết nguyên tử là sự mô tả của các nguyên tử, những đơn vị nhỏ nhất của các nguyên tố. Bằng chứng khoa học cho sự tồn tại của các nguyên tử và những thành phần còn nhỏ hơn của nó có quá nhiều, cho nên đa số mọi người ngày nay xem sự tồn tại của nguyên tử là một thực tế, chứ không đơn giản chỉ là một lí thuyết.
Lịch sử
Bắt đầu vào khoảng năm 600 trước Công nguyên, nhiều nhà triết học Hi Lạp đã nỗ lực tìm hiểu bản chất của vật chất. Một số người cho rằng vạn vật cấu tạo từ nước, chúng có ba dạng (băng ở thể rắn, nước lỏng và hơi nước). Một số người khác thì tin rằng vật chất cấu tạo hoàn toàn từ lửa ở dạng biến đổi không ngừng. Tuy nhiên, những người khác thì tin rằng cho dù vật chất cấu tạo từ cái gì thì nó phải là cái gì đó không thể bị phá hủy mà chỉ kết hợp lại thành những dạng thức mới. Nếu họ có thể nhìn thấy những cái đủ nhỏ, họ sẽ thấy những “viên gạch cấu trúc” của chúng. Một trong nhà triết học này có tên gọi là Democritus. Ông tưởng tượng bắt đầu với một mẩu lớn vật chất và dần dần chia cắt nó thành những mẩu mỗi lúc một nhỏ hơn, cuối cùng thì đạt tới mẩu nhỏ nhất. Viên gạch cấu trúc nhỏ nhất không thể chia cắt được nữa này được gọi là atomos, tiếng Hi Lạp có nghĩa “không thể chia cắt”. Từ atomos bước sang thời kì hiện đại đã biến đổi thành atom (nguyên tử). Các nguyên tử mà Democritus hình dung ra chỉ khác nhau về hình dạng và kích cỡ. Trong lí thuyết của ông, những vật khác nhau trông khác nhau vì cách các nguyên tử sắp xếp. Aristotle, một trong những nhà triết học có sức ảnh hưởng nhất của thời kì ấy, tin vào một số loại “phần tử nhỏ nhất” của vật chất nhưng không theo các mô tả của Democritus. Aristotle nói chỉ có bốn nguyên tố (đất, không khí, lửa, nước) và những nguyên tố này có một số đơn vị nhỏ nhất cấu tạo nên toàn bộ vật chất. Sự thuyết giáo của Aristotle chống lại quan điểm nguyên tử của Democritus quá mạnh mẽ nên quan điểm nguyên tử đã bị gạt ra khỏi thế giới triết học trong 2000 năm sau đó.
Mặc dù thuyết nguyên tử bị bỏ rơi trong khoảng thời gian lâu dài như vậy, nhưng sự thực nghiệm khoa học, đặc biệt là hóa học, đã phát triển. Từ thời Trung cổ (khoảng năm 1100) về sau, nhiều phản ứng hóa học đã được nghiên cứu. Vào thế kỉ thứ 17, một số nhà hóa học này bắt đầu nghĩ tới những phản ứng mà họ nhìn thấy dưới dạng những phần tử nhỏ nhất. Thậm chí, họ còn bắt đầu sử dụng từ nguyên tử trở lại. Một trong những nhà hóa học nổi tiếng nhất vào cuối thế kỉ thứ 18 là Antoine Lavoisier. Các thí nghiệm hóa học của ông đã cân rất kĩ tất cả các hóa chất. Ông cho những chất khác nhau phản ứng cho đến khi chúng ở trạng thái đơn giản nhất của chúng. Ông tìm ra hai yếu tố quan trọng: (1) những chất đơn giản nhất, cái ông gọi là nguyên tố, không thể bị phân tách thành chất khác nữa, và (2) những nguyên tố này luôn phản ứng với nhau theo những tỉ lệ giống nhau. Những chất phức tạp hơn mà giống nhau đó ông gọi là hợp chất. Thí dụ, hai thể tích hydrogen phản ứng chính xác với một thể tích oxygen để tạo ra nước. Nước có thể bị phân tách luôn cho chính xác hai thể tích hydrogen và một thể tích oxygen. Lavoisier không có sự giải thích nào cho những kết quả nhất quán bất ngờ này. Tuy nhiên, vô số những phép đo thận trọng của ông đã cung cấp manh mối cho một nhà hóa học khác tên là John Dalton.
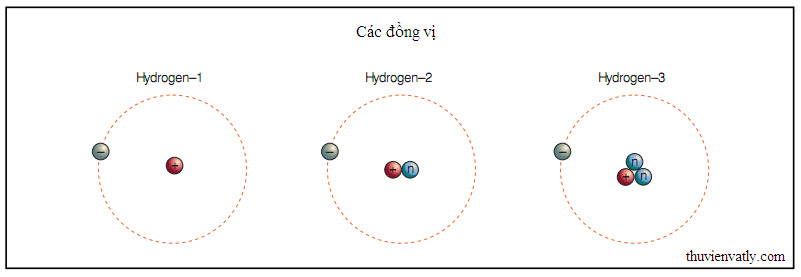
Dalton nhận ra rằng nếu như các nguyên tố cấu tạo gồm những nguyên tử, mỗi nguyên tố khác nhau có một loại nguyên tử riêng, thì thuyết nguyên tử có thể giải thích các kết quả của Lavoisier. Nếu hai nguyên tử hydrogen luôn luôn kết hợp với một nguyên tử oxygen, thì tổ hợp nguyên tử thu được, gọi là phân tử, sẽ là nước. Dalton công bố sự giải thích của ông vào năm 1803. Năm này được xem là năm ra đời của thuyết nguyên tử hiện đại. Các thí nghiệm khoa học sau Dalton đã cố gắng mô tả đặc trưng xem có bao nhiêu nguyên tố, nguyên tử của mỗi nguyên tố trông như thế nào, các nguyên tử thuộc cùng một nguyên tố giống nhau như thế nào và chúng khác nhau như thế nào và, cuối cùng, liệu có cái gì nhỏ hơn nguyên tử nữa hay không.
Mô tả các đặc trưng của nguyên tử
Một trong những thuộc tính đầu tiên của các nguyên tử được mô tả là trọng lượng nguyên tử tương đối. Mặc dù một nguyên tử đơn lẻ là quá nhỏ để mà cân, nhưng người ta có thể so sánh các nguyên tử với nhau. Nhà hóa học Jons Berzelius giả sử rằng những thể tích khí bằng nhau ở điều kiện nhiệt độ và áp suất như nhau chứa số lượng nguyên tử ngang nhau. Ông đã sử dụng quan điểm này để so sánh trọng lượng của các chất khí đang phản ứng. Thí dụ, ông có thể xác định rằng nguyên tử oxygen nặng gấp 16 lần nguyên tử hydrogen. Ông đã lập danh sách những trọng lượng nguyên tử tương đối này cho nhiều nguyên tố mà ông biết. Ông đã nghĩ ra kí hiệu cho các nguyên tố bằng cách sử dụng kí tự thứ nhất hoặc hai kí tự đầu tiên trong tên gọi Latin của chúng, hệ thống kí hiệu đó vẫn được sử dụng ngày nay. Kí hiệu cho hydrogen là H, cho oxygen là O, cho natrium là Na, và vân vân. Những kí hiệu đó còn tỏ ra hữu ích trong việc mô tả nhiều nguyên tử kết hợp với nhau như thế nào để tạo ra phân tử thuộc một hợp chất nào đó. Thí dụ, để thể hiện nước có cấu tạo gồm hai nguyên tử hydrogen và một nguyên tử oxygen, kí hiệu cho nước là H2O. Một nguyên tử oxygen còn có thể kết hợp với một nguyên tử oxygen khác để tạo ra một phân tử oxygen với kí hiệu O2.

Sự phát triển của thuyết nguyên tử
Khi người ta khám phá ra ngày một nhiều nguyên tố hơn, cái tiện lợi là nên bắt đầu lập danh sách chúng ở dạng kí hiệu trong một biểu đồ. Năm 1869, Dmitri Mendeleev đã lập danh sách các nguyên tố theo trật tự trọng lượng nguyên tử tăng dần và phân nhóm những nguyên tố dường như có những phản ứng hóa học giống nhau. Thí dụ, lithium (Li), natrium (Na), và kalium (K) đều là những nguyên tố kim loại bốc cháy khi chúng bị ẩm. Trong biểu đồ của ông, những nguyên tố tương tự nhau được đặt trong cùng một cột. Mendeleev bắt đầu nhìn thấy một kiểu phân bố trong số các nguyên tố, trong đó mỗi tám nguyên tố trên danh sách liệt kê trọng lượng nguyên tử sẽ thuộc về cùng một cột. Do sự lặp lại hay tuần hoàn của kiểu phân bố này, nên biểu đồ của Mendeleev được người ta gọi là “Bảng tuần hoàn hóa học”. Thật ra, bảng tuần hoàn đó không đều lắm, vì có những “chỗ trống” trong bảng. Mendeleev dự đoán rằng cuối cùng người ta sẽ khám phá ra nguyên tố lấp đầy chỗ trống đó. Chẳng hạn, có một khoảng trống dành cho một nguyên tố với trọng lượng nguyên tử khoảng 72 (nặng hơn hydrogen 72 lần) nhưng là nguyên tố chưa biết. Năm 1886, 15 năm sau sự dự đoán của nó, nguyên tố Germanium (Ge) đã được tách li và người ta thấy nó có trọng lượng nguyên tử 72,3. Nhiều nguyên tố khác tiếp tục được dự đoán và tìm ra theo cách như vậy. Tuy nhiên, khi có thêm nhiều nguyên tố bổ sung vào bảng tuần hoàn hóa học, người ta thấy nếu một số nguyên tố được đặt trong những cột thích hợp do những phản ứng giống nhau của chúng, thì chúng không tuân theo trật tự đúng của trọng lượng nguyên tử tăng dần. Một số đặc trưng nguyên tử khác là cần thiết để sắp xếp có trật tự các nguyên tố. Nhiều năm trôi qua trước khi tính chất thích hợp đó được tìm thấy.
Khi các thí nghiệm hóa học tìm kiếm và mô tả đặc trưng được nhiều nguyên tố hơn, những ngành khoa học khác đã và đang thực hiện những khám phá về dòng điện và ánh sáng đã góp phần cho sự phát triển của thuyết nguyên tử. Michael Faraday đã tiến hành nhiều nghiên cứu mô tả đặc trưng dòng điện; James Clerk Maxwell mô tả đặc trưng ánh sáng. Vào những năm 1870, William Crookes đã chế tạo một thiết bị, ngày nay gọi là ống Crookes, để khảo sát những “tia” do kim loại giải phóng ra. Ông muốn biết những tia ấy là ánh sáng hay dòng điện dựa trên nghiên cứu của Faraday lẫn Maxwell. Ống Crookes gồm một bóng đèn thủy tinh, trong đó đa phần không khí đã bị rút ra, bọc hai bản kim loại gọi là hai điện cực. Một điện cực gọi là anode, còn điện cực kia gọi là cathode. Mỗi bản có một dây dẫn nối bóng chân không với một nguồn điện. Khi nối điện cho các điện cực, các tia phát ra từ phía cathode. Crookes xác định được những tia cathode này là những hạt có điện tích âm do kim loại giải phóng khỏi bản cathode. Năm 1897, J.J. Thomson phát hiện thấy những hạt tích điện âm này giải phóng từ nguyên tử ra và phải có mặt trong các nguyên tử kim loại lúc ban đầu. Ông gọi những hạt hạ nguyên tử tích điện âm này là “electron”. Vì electron mang điện âm, nên phần còn lại của nguyên tử phải mang điện dương. Thomson tin rằng các electron phân tán trong nguyên tử giống như những miếng nho rắc trong bánh bông lan vậy. Mặc dù mẫu “bánh bông lan rắc nho” của Thomson là không chính xác, nhưng nó là nỗ lực đầu tiên cho thấy các nguyên tử thật ra phức tạp hơn những quả cầu thuần nhất.
Vào thời gian ấy, các nhà khoa học đang khảo sát những loại tia bí ẩn khác phát ra từ ống Crookes và không phát sinh tại cathode của nó. Năm 1895, Wilhelm Roentgen để ý thấy những tấm kính ảnh để gần một ống Crookes sẽ trở nên mờ đi do một số tia chưa biết, không nhìn thấy nào đó gây ra. Roentgen gọi những tia này là “tia X”, với chữ “x” là biến chưa biết trong toán học. Roentgen còn chứng minh việc sử dụng các tấm kính ảnh là một phương pháp chụp ảnh của những tia bí ẩn đó. Ông nhận thấy khi dùng tay của ông chặn tia X lại, chẳng hạn, xương trong bàn tay chặn được tia X nhưng da và các mô thì không. Các bác sĩ vẫn sử dụng tia X của Roentgen để chụp ảnh cơ thể con người.
Kính ảnh trở thành thiết bị chuẩn đối với các nhà khoa học thuộc thời đại của Roentgen. Một trong những nhà khoa học này, Henri Becquerel, đã để một số kính ảnh trong ngăn kéo cùng với uranium, một nguyên tố mới mà ông đang nghiên cứu. Khi ông mang kính ảnh ra, ông nhận thấy chúng bị mờ đi. Vì chẳng có cái gì khác ở trong ngăn kéo nữa, cho nên ông kết luận rằng uranium phải giải phóng một loại tia nào đó. Becquerel chỉ ra rằng bức xạ này không có tính đâm xuyên như tia X vì nó có thể bị giấy chặn lại. Chính nguyên tố uranium tự sinh ra bức xạ, một tính chất gọi là sự phóng xạ. Phần lớn qua nghiên cứu của Pierre và Marie Curie, người ta tìm ra thêm nhiều chất phóng xạ khác. Những nỗ lực nhằm mô tả những loại phóng xạ khác nhau đã đưa đến chương quan trọng tiếp theo trong sự phát triển của thuyết nguyên tử.
Năm 1896, Ernest Rutherford, một sinh viên của J.J. Thomson, bắt đầu nghiên cứu sự phóng xạ. Khi kiểm tra những nguyên tố khác nhau và xác định xem những loại chất liệu nào có thể chặn được bức xạ đi đến kính ảnh, Rutherford kết luận rằng có hai loại phóng xạ phát ra từ các nguyên tố. Ông đặt tên cho chúng bằng hai kí tự đầu tiên của bảng chữ cái Hi Lạp, alpha và beta. Bức xạ alpha gồm những hạt tích điện dương nặng gấp bốn lần nguyên tử hydrogen. Bức xạ beta gồm những hạt tích điện âm dường như giống hệt như các electron. Rutherford quyết định thử một thí nghiệm sử dụng hạt alpha. Ông bố trí một lá vàng mỏng với những tấm kính ảnh đặt xung quanh nó. Sau đó, ông cho các hạt alpha đi tới lá vàng. Phần lớn các hạt alpha đi thẳng qua lá vàng. Nhưng một vài hạt alpha không đi như vậy. Một vài hạt alpha bị lệch khỏi quỹ đạo thẳng của chúng. Rutherford viết rằng thật bất ngờ vì điều đó tương tự như bắn một viên đạn vào một mảnh giấy mà viên đạn bị dội ngược trở lại. Rutherford kết luận rằng vì đa số hạt alpha đi xuyên qua, cho nên các nguyên tử vàng chủ yếu phải là không gian trống rỗng, chứ không giống như mẫu bánh bông lan đầy kín của Thomson. Vì một vài hạt alpha bị chệch hướng, nên phải có một vùng tích điện dương rất đặc trong mỗi nguyên tử gọi là hạt nhân. Với toàn bộ điện tích dương ở hạt nhân, câu hỏi tiếp theo là các electron trong nguyên tử sắp xếp như thế nào.
Năm 1900, nhà vật lí Max Planck đang nghiên cứu các quá trình ánh sáng và nhiệt, đặc biệt tìm hiểu bức xạ ánh sáng phát ra bởi một “vật đen”, một hộp lí tưởng có những thành phản xạ hoàn hảo. Người ta tưởng tượng những hộp này chứa những vật gọi là dao động tử hấp thụ và phát xạ ánh sáng và nhiệt. Cho đủ thời gian thì bức xạ phát ra từ một vật đen như vậy sẽ tạo ra một sự phân bố ánh sáng nhiều màu sắc gọi là quang phổ chỉ phụ thuộc vào nhiệt độ của vật đen chứ không phụ thuộc vào thành phần cấu tạo của nó. Nhiều nhà khoa học đã nỗ lực đi tìm một mối liên hệ toán học dự đoán những dao động tử của một vật đen có thể tạo ra một sự phân bố phổ đặc biệt như thế nào. Max Planck đã tìm ra mối liên hệ toán học chính xác đó. Ông giả định rằng năng lượng hấp thụ hoặc phát ra bởi các dao động tử luôn luôn là bội số của một số “gói năng lượng” cơ bản mà ông gọi là một lượng tử. Các vật phát xạ hay hấp thụ năng lượng thành từng phần rời rạc, gọi là các lượng tử.
Vào thời gian này, có một nhà vật lí đang nghiên cứu với Thomson và Rutherford tên gọi là Niels Bohr. Bohr nhận thấy rằng quan điểm lượng tử năng lượng có thể giải thích các electron trong nguyên tử sắp xếp như thế nào. Ông mô tả các electron đang “ở trên quỹ đạo” xung quanh hạt nhân giống hệt như các hành tinh quay xung quanh mặt trời. Giống như các dao động tử trong một vật đen không thể phát ra những lượng năng lượng bất kì, các electron trong nguyên tử không thể có quỹ đạo bất kì. Chỉ những khoảng cách nhất định mới được năng lượng mà mỗi electron có cho phép. Nếu một electron thuộc một nguyên tử nào đó hấp thụ một lượng tử năng lượng chính xác, thì nó có thể chuyển lên một quỹ đạo ở xa hạt nhân hơn. Nếu một electron ở quỹ đạo xa hạt nhân phát ra một lượng tử năng lượng chính xác, thì nó có thể chuyển xuống quỹ đạo gần hạt nhân hơn. Những giá trị năng lượng chính xác đó khác nhau đối với những nguyên tố khác nhau. Những giá trị này có thể xác định bằng một quá trình gọi là quang phổ nguyên tử, một kĩ thuật thực nghiệm khảo sát quang phổ ánh sáng do các nguyên tử tạo ra. Một nguyên tử được làm nóng đến mức toàn bộ các electron của nó chuyển ra xa hạt nhân hết. Khi chúng chuyển xuống gần hạt nhân hơn, các electron bắt đầu phát ra những lượng tử năng lượng của chúng dưới dạng ánh sáng. Quang phổ của ánh sáng tạo ra có thể được người ta khảo sát bằng một lăng kính. Quang phổ tạo ra theo kiểu này không thể hiện hết mọi màu sắc, mà chỉ có một vài màu phù hợp với năng lượng tương ứng những sự chênh lệch quỹ đạo electron. Mặc dù sau này có tinh chỉnh thêm, nhưng “mô hình hành tinh” nguyên tử của Bohr giải thích được số liệu quang phổ nguyên tử đủ tốt nên các nhà khoa học đã chuyển sự chú ý của họ trở lại với hạt nhân nguyên tử.