
Click dê? vê` mu?c lu?c
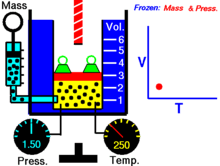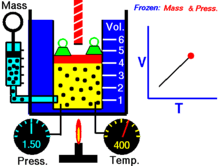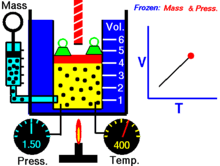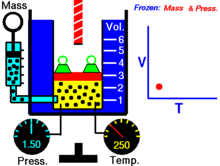
Hoạ cảnh nêu lên mối quan hệ giữa thể tích và nhiệt độ tuyệt đối.
Định luật Charles hay Định luật Gay-Lussac là một định luật quan trọng về các chất khí được sử dụng nhiều trong chương nhiệt động và hóa lư của ngành hoá học. Định luật lấy tên theo Joseph Louis Gay-Lussac, được phát biểu như sau:
Với lượng khí n không đổi ở áp suất p không đổi th́ tỉ số giữa thể tích V và nhiệt độ T không đổi hay thể tích và nhiệt độ tỉ lệ thuận trực tiếp với nhau
n = const, p = const →
V/T = const, V = const.T
Lượng khí không đổi cùng áp suất ở trạng thái 1 và 2 th́ V1/T1
= V2/T2 hay V1T2 = V2T1
Đây là trường hợp đặt biệt của
phương tŕnh khí lư tưởng pV = nRT.
Mối liên hệ giữa V và T được Jacques Charles phát hiện năm 1787 nhưng không công bố, Gay-Lussac phát biểu định luật này vào năm 1802, v́ vậy định luật này c̣n có tên định luật Charles.
Các công thức trên là cách viết khác của định luật Gay-Lussac thực sự: V(T) = V0[1 + a0(T - T0)]
với V0, a0 = 1/T0 là thể tích, hệ số giản đẳng áp khí ở nhiệt độ chuẩn (0°C) T0 = 273,15 K
V(T): thể tích khí ở nhiệt độ T
hay tổng quát với khí lư tưởng: V2 = V1[1 + aV(T2 - T1)], trong đó aV = 1/T1
Lấy từ “https://vi.wikipedia.org/wiki/%C4%90%E1%BB%8Bnh_lu%E1%BA%ADt_Charles”